トップページ>講座概要>がん薬物療法の更なる進歩を期して>4. がん薬物療法のパラダイムシフト
がん薬物療法の更なる進歩を期して
4. がん薬物療法のパラダイムシフト
がん薬物療法の歴史は、ナイトロジェンマスタードがHodgikin Lymphomaに有効と報告された1942年にさかのぼる6)。初めて固形がんに対する有効性が示されたのは1958年のCholiocarcinomaに対するメトトレキセートの有効性である7)。
しかし、血液腫瘍とは異なり、固形がんに対する抗悪性腫瘍薬の治療成績は長らく低迷した。
例えば、進行大腸がんの生存期間の中央値(median survival time, MST)は1990-1991年には約12ヶ月であり、5年生存率は1990-1994年には10%未満であった 8)。当時の固形がんの薬物療法の主力となっていた抗悪性腫瘍薬は、いずれも細胞に対する選択性の低いcytotoxic agentである。したがって、増殖が盛んな正常細胞に対するダメージは不可避で血液毒性、消化器毒性に代表される有害事象(副作用)が高頻度に発生した。
その後、僅かずつではあるが、進行大腸がんの治療成績は、しかし確実に向上し始める。
1990-1991年に約12ヶ月であったMSTは2004-2006年には30ヶ月に近づき、また、1990-1994年には10%未満であった5年生存率は2004-2006年には30%を超えるまでに至っている8)。
このような治療成績の進歩の背景には2004年に登場したベバシズマブ(BV)、そしてセツキシマブ(Cmab)といった分子標的薬の寄与するところが大きい8)。分子標的薬の嚆矢は2001年のイマチニブの慢性骨髄性白血病(CML)に対する承認である9)。イマチニブはCMLの原因であるBCR-ABLキメラがん遺伝子産物のチロシンキナーゼ活性を特異的に阻害する10)。その治療効果は血液学的完全寛解が90%以上というように絶大であった。
これらの分子標的薬はがん化において鍵となる分子、例えばイマチニブの場合ではBCR-ABLといった細胞増殖の制御に関する分子を、BVではVascular Endothelial Growth Factor(VEGF)といった血管新生に関する分子を制御する。分子標的薬の登場は分子病態に立脚した、より理論的な薬物療法の実践を可能にした。これらの進歩の総体として、今日では表に示すように多くの固形がんが薬物療法に対して一定の効果を示すようになっている。
大腸がんは部位別の死亡数において平成19年には男性は第3位、女性では第1位である。「大腸癌治療ガイドライン」に記載された進行再発大腸がんの治療方針は、切除不可能な場合、Performance Statusの良いケースでは全身化学療法が適応となる。
進行再発大腸がんにおいて用いられる抗悪性腫瘍薬は、cytotoxic agent としては5-FU、塩酸イリノテカン(CPT-11)、オキサリプラチン(l-OHP)である。5-FUは核酸代謝拮抗薬でDNAの合成阻害とRNAの機能障害を引き起こす。
CPT-11はトポイソメラーゼIの阻害剤、l-OHPは第三世代の白金誘導体である。5-FU単独の時代には進行再発大腸がんのMSTは10.5ヶ月であった。次いで、これに還元型葉酸、l-ロイコボリン(l-LV)を加えて、5-FU、チミジル酸合成酵素(Thymidylate Synthase)との間に三者共役体を形成させ、バイオケミカルモジュレーションを行うレジメンが登場した。
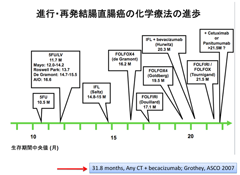
5-FUを持続投与するDeGramont11)やAIOレジメン12)によってMSTの更なる延長が認められた(MST=16.6ヶ月)。
その後、CPT-11と5-FUの多剤併用療法であるIFL療法やFOLFIRI療法が開発され13)、MSTは17.1ヶ月に達した。特にFOLFIRI療法は現在、keyとなる治療法の一つである。
さらにl-OHPと5-FUの併用療法であるFOLFOX療法が開発された。FOLFOX療法にも様々な派生型のレジメンが存在するが、当初、我が国で幅広く用いられたのはFOLFOX4であり14)、その後、day2の5-FUのbolus投与を省略するなどしたmodified FOLFOX6が汎用されている15)。FOLFIRIとFOLFOX療法は、どちらか先行させた治療が無効となった時点で、もう一方に引き継ぐことによりMSTは21.5ヶ月にまで延長できることが示された13)(図-9)。
現在では、5-FU、CPT-11、そしてl-OHPの3剤を全て使い切ることが、進行再発大腸がんの患者に最もベネフィットをもたらすとされている。2004年、進行再発大腸がんの薬物療法にBVがFDAの承認を受けた。BVは単剤では効果を示さないが、FOLFIRIやFOLFOX療法と併用することで上乗せ効果を発揮する。血管新生の阻害剤で、腫瘍血管を間引くことで腫瘍の間質圧を下げ、cytotoxic agentのデリバリーを向上させる作用がある。FOLFIRIやFOLFOX療法に対する上乗せ効果として無増悪生存期間を約2~3ヶ月程度延長させる 16) 17)。進行再発大腸がんの分子標的薬としては、この他にCmab、同じく完全ヒト化モノクローナル抗体であるパニツムマブ(Pmab)がある。
Cmabは2008年に我が国においても使用可能となり、単剤でも効果があることが示されている。その奏効率はセカンド、サードラインで約10%程度であるが、海外ではファーストラインから用いられており、FOLFIRIともFOLFOXとも併用される18) 19)。
現在知られているEGFR抗体の最大の効果予測因子はKRAS遺伝子変異の有無である。KRASはEGFRの下流に位置するシグナル伝達分子であり、大腸がんでは約50%にKRAS遺伝子の活性型変異が見出される。KRASに活性型変異が存在すれば、その上流のEGFRをCmabやPmabで抑えても抗腫瘍効果を期待できない20) 21)。EGFRに始まるシグナル伝達系にはKRASの下流のBRAF、MAPキナーゼ、さらにPI3キナーゼなど、その他のパスウェイも存在し、これらの遺伝子を診断することの臨床的重要性については現在、解析が進行している。分子標的薬は高額な医薬品であるので、投与にあたってレスポンダーを正しく抽出することは医療費削減の観点からも重要である。
分子標的薬はcytotoxic agentと異なり、当初、有害事象は少ないのではないかと予想された。しかし、分子標的薬にも個々の薬剤に特有の有害事象が起きることが判明した。頻度は低いが、中には致命的な転帰をたどるような重篤なものも含まれており、注意が必要である。BVの有害事象は欧州の大規模市販後調査(First BEAT study)の結果、高血圧が28.5 %、蛋白尿が8.8 %、重篤な消化管出血(Grade 3以上)が2.6 %、重篤な動脈塞栓症が1.1 %、重篤な消化管穿孔が1.7%と報告された 22)。
Cmabの有害事象は本邦における市販直後調査の結果(3,046例を対象とした)によるとinfusion reactionが3.6 %(そのうち重篤なものは1.2 %)、皮膚症状が45.9 %(重篤なものは1.3 %)、消化管障害が10.2 %(重篤なものは1.5 %)、低マグネシウム血症などの電解質異常が3.9 %(重篤なものは0.2 %)、間質性肺炎が0.5 %と報告された。1,079例を対象としたPmabの有害事象の報告(ただし、Grade 3以上の重篤なもの)によると、infusion reactionが0.1 %、皮膚症状が6.7 %、爪周囲炎が0.6 %、下痢が4.4 %、低マグネシウム血症が0.8 %であった23)。
Pmabは完全ヒト化モノクローナル抗体であるのでCmabよりもinfusion reactionの発現は低い。また、CmabもPmabも、皮疹が強く出る方が効果のあることが判明している。BVでは高血圧クリーゼや血栓症、消化管穿孔には十分な注意が必要で、これらのハイリスクの群には投与を控えるべきである。また、CmabやPmabでは皮膚症状が高頻度に出現するので、これらに対する予防やケアが必要となる。
現在、FOLFOX療法やFOLFIRI療法では5-FUの持続投与のために埋込式皮下ポートの造設が必要である。今後の展開として、医療資源および患者の利便性の観点からポートを必要としない方法が模索されている。そこでは5-FUの持続投与に代わり、経口の5-FUプロドラッグを用いる。
経口5-FUのプロドラッグとしては、capecitabine、doxofluridine、tegafur、およびtegafurとuracilの合剤であるUFTとtegafur / gimeracil / oteracilの合剤であるS-1がある。なかでも、capecitabineを用いた組み合わせであるXELOX、XELIRI24) 25)、CapIRI、CapOXやS-1を用いた組み合わせであるSOX、IRISなどの臨床試験の結果が続々と公表されている26) 27)。私も参加した臨床試験等を経て、これらの経口フッ化ピリミジンを用いた方法と旧来の方法との同等性が証明されつつある。
進行再発大腸がんは数年前まで表におけるC群、すなわち「症状の改善が期待できる」グループに属していた。しかし、今日ではB群、「延命が期待できる」グループに格上げされた。これに分子診断による効果予測による個別化医療が開始され、進行再発大腸がんの薬物療法は今後も大きく進化してゆくものと思われる。