トップページ>講座概要>がん薬物療法の更なる進歩を期して>2. がんの分子病態の解明を目指して
がん薬物療法の更なる進歩を期して
2. がんの分子病態の解明を目指して
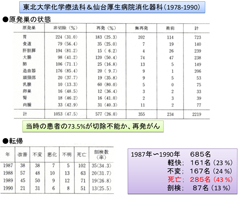
私が医学部を卒業し、がんの薬物療法の道に入ったのは1987年のことである。当時の固形がんの薬物療法は、まだ開発途上にあり、その治療成績は惨憺たるものであった2)(図-1)。
また、1990年代半ばには「患者よ、がんと闘うな」という小誌が刊行され、そこには「抗がん剤は効かない」、「抗がん剤は命を縮める」といった激越な見出しが並んでいた。当時の固形がんの薬物療法は、これを論破するほどの治療成績を提示できない状況であった。その理由を端的に言えば、がんの生物学的理解があまりにも乏しかったことに尽きる。孫子に曰く、「敵を知り、己を知らば、百戦して危うからず。」である。
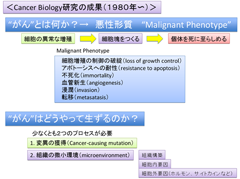
今日では、“がん”という病態は細胞が悪性形質を獲得し、異常増殖を営み、細胞塊を形成して、ついには個体を死に至らしめるものと理解されている。悪性形質には細胞増殖の制御の破綻、アポトーシスへの耐性、不死化、血管新生、そして浸潤・転移などが含まれる(図-2)。がんを生じるには “がん”を引き起こす変異の獲得があり、もうひとつに“がん”の存在する微小環境の再構築がある。
悪性形質の獲得にはOncogeneの変異やTumor Suppressorの機能消失などを含む多くの遺伝子変異が関与し、これらが蓄積し、悪性度が増してゆくことが判明した。
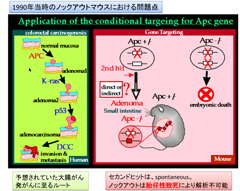
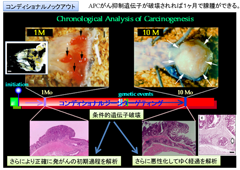
そのような中、1990年代、私は診療よりも、もっぱらがんの分子生物学的研究に没頭した。当時、私はノックアウトマウスを用いて大腸がん発がんの分子機構の研究を行っていた。大腸がん発がんは腺腫、腺がん、浸潤がん、転移性がんという多段階のプロセスを経て、発生、進展し、各ステップに対応するAPC、KRAS、p53、DCCなどの遺伝子異常の関与が示唆されていた。しかし、ノックアウトの技術では胎仔性致死の壁に阻まれ、in vivoでこれらを証明することは不可能であった( 図-3)。
そこでCre/loxP組換えシステムを利用したコンディショナルターゲティングという方法を確立し、これをApc遺伝子に応用した。その結果、Apc遺伝子をマウスの直腸粘膜で破壊すると、早くも21日目には腺腫が形成されることが確認され、大腸がんの多段階発がんのイニシエーションにおけるApc遺伝子の直接的な役割を証明した3)( 図-4)。世界に先駆けたコンディショナルターゲティングのがん研究への応用であった。
その後、このマウスを用いてApc遺伝子が乳腺、腎臓、卵巣、前立腺にも腫瘍をつくるポテンシャルがあることが証明された(図-5)。
今日、APCはWntシグナル伝達系に属する分子でβ-Cateninの分解に関与することが判明している。APC遺伝子が破壊されると細胞内にβ-Cateninが蓄積し、これが核内に移行し、転写因子としてc-MycやCyclinD1といったOncogeneの転写活性化を引き起こす。