トップページ>講座概要>がん薬物療法の更なる進歩を期して>3. がんの分子制御法を見いだすために
がん薬物療法の更なる進歩を期して
3. がんの分子制御法を見いだすために
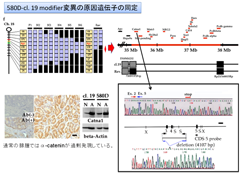
そのようなマウスを用いた分子生物学的な研究を行っていたところ、発がんを制御するヒントとなるような事象に遭遇した。Germ lineでApc遺伝子に変異のあるマウスは消化管ポリポーシスを呈し、ヒトの家族性大腸腺腫症(familial adenomatous polyposis, FAP)のモデルマウスとなる。私が樹立したFAPモデルマウスの中にApc遺伝子に変異があるにもかかわらず、ポリポーシスにならない1亜系(clone 19)が存在することに気がついた( 図-6)。
この亜系にはApc遺伝子変異に起因する発がんを制御する変異(modifier変異)があると考えた。その後、近交系マウスへの戻し交配を利用した分子遺伝学的な方法により、modifier変異の原因遺伝子を同定した。
それは細胞内でE-Cadherinを裏打ちする細胞接着因子α-Cateninであった4)(図-7)。
浸潤がん、転移がんではα-Cateninの喪失が観察されており、浸潤・転移との関連が論じられてきたが、前がん病変におけるα-Cateninの役割については、さらなる解明が必要である。
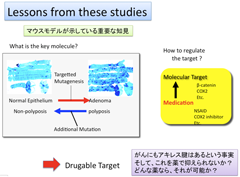
私の記憶ではFAPのmodifierとして最もインパクトを示したのはCOX2である。Apc遺伝子変異があってもCOX2遺伝子がノックアウトされているとポリープ数は激減する。これらの結果に基づいてCOX2の特異的インヒビター、セレコキシブの臨床試験が行われた。腺腫形成の抑制を認めたが、循環器系の有害事象が27.3 %に出現したため、セレコキシブは予防剤としては不適切であると結論された 5)。
マウスの分子遺伝学的な実験から得られた教訓として、発がんのOn/Offもクリティカルな遺伝子の制御によって達成することができるという事実である(図-8)。 私も体験した「がん研究の多くの成果」は、がんの薬物療法に還元され、特に分子標的治療という新しいがん薬物療法の飛躍的な進歩の大きな礎になった。