情報制御学・実験治療学
組織紹介
医学専攻 機能展開医学系:情報制御学・実験治療学講座 の概要
詳しくは、当該 医学専攻 情報制御学・実験治療学講座 ホームページをご覧ください。
構成員の紹介
| 教授 | 齋藤 康太 | Kota SAITO |
|---|---|---|
| 助教 | 前田 深春 | Miharu MAEDA |
| 助教 | 荒川 将志 | Masashi ARAKAWA |
| 技術職員 | 小松 幸恵 | Yukie KOMATSU |
教育と研究の概要
主な担当授業
主な学部の授業
2年次
講義:原因と病態(生体と薬物)
実習:生体機能学実習(薬物代謝、用量作用曲線の解析)
主な研究対象
主な研究内容
- 巨大分子コラーゲンの分泌機構の解明
- 巨大分子キロミクロンの分泌機構の解明
- 小胞体出芽部位形成機構の解明
- 肝繊維化抑制の新規標的の探索
医学専攻 機能展開医学系:情報制御学・実験治療学講座の概要
1)巨大分子コラーゲンの分泌機構の解明
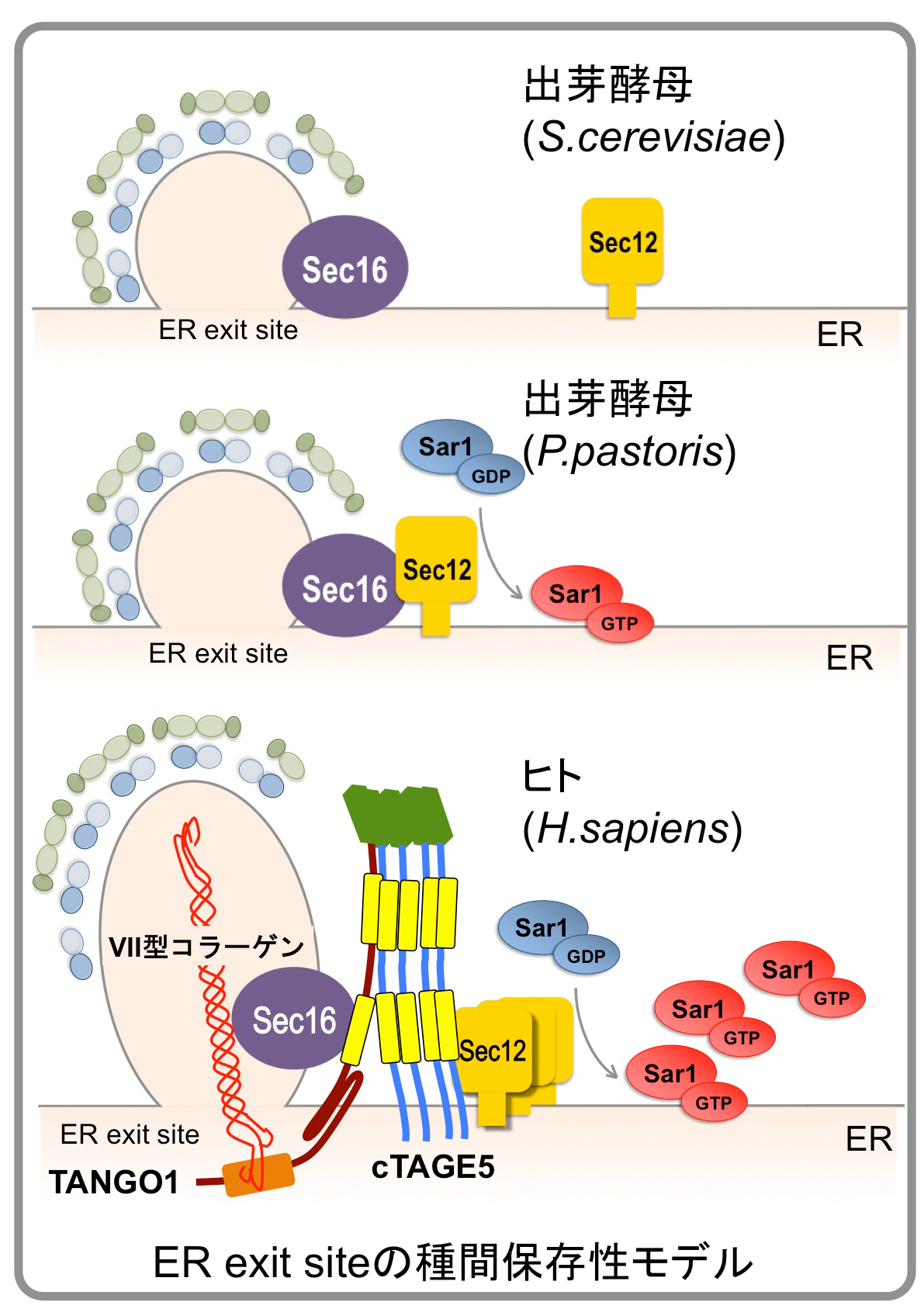
コラーゲンは全タンパク質の約3割を占め、生体内で最も多いタンパク質ですが、小胞体で合成されたのち巨大な複合体を形成し、通常の輸送小胞に入りきらないため、分泌機構は未解明です。わたしたちの講座では、コラーゲンの小胞体からの分泌に特異的に関与するタンパク質群(cTAGE5/TANGO1/Sec12)を同定し機能解析を行なってきましたが、機能の解明にはまだまだ今後の解析が必要です。わたしたちは「巨大分子コラーゲンの分泌機構の解明」を目指しています。
2)巨大分子キロミクロンの分泌機構の解明
キロミクロンはリポタンパク質の一種で、食事で取り込んだ脂肪を全身の組織に送る役割を担っていますが、これも小胞体で巨大な複合体として合成されます。最近、キロミクロンの分泌もコラーゲンとよく似た機構であることが明らかとなってきましたが、詳細は不明です。わたしたちは「巨大分子キロミクロンの分泌機構の解明」を目指しています。
3)小胞体出芽部位形成機構の解明
哺乳細胞の小胞体出芽ドメイン(ER exit site)は、1つの細胞あたり数百個存在しますが、細胞周期や栄養状態などによって、その数や大きさ、局在が変化することが知られています。しかし、その分子機構はあまり明らかになっていません。私たちのグループは、最近コラーゲンの積荷受容体TANGO1がER exit siteの局在の決定にも関与することを明らかにしました。この結果を足がかりにして、高等真核生物でのER exit siteの局在がどのように決定されるのか、またER exit siteがどのように作られるのか(バイオジェネシスの分子機構)を明らかにしたいと考えています。最近、私達のグループは細胞分裂期のER exit siteの崩壊と再形成に、TANGO1のリン酸化が重要な役割を担っていることを明らかにしました。この研究は、ER exit siteが関係する病気(がんなど)の治療法の開発などに役立つことが期待されます。
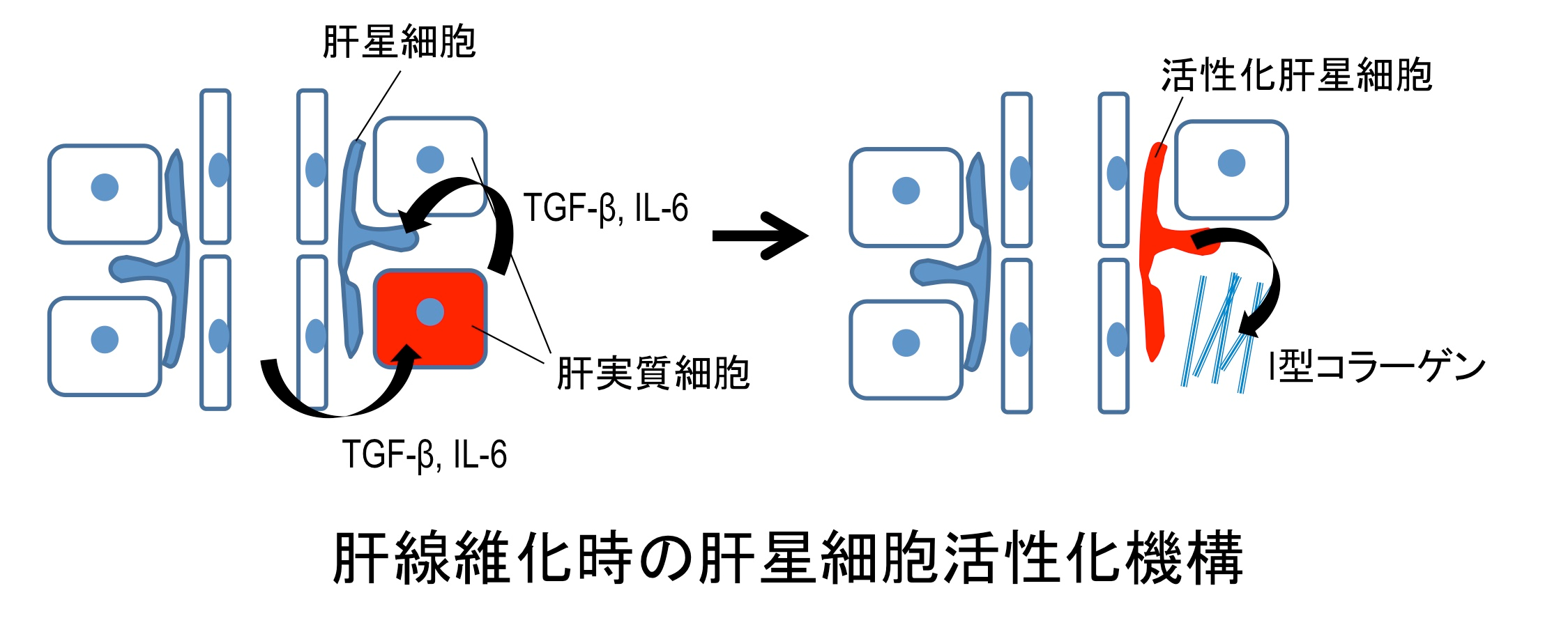
4)肝繊維化抑制の新規標的の探索
ウイルス性慢性肝炎に対する治療法の進歩により、今後非アルコール性脂肪肝炎(NASH)が慢性肝炎の主因になることが予想されることから、肝繊維化を直接阻害する治療薬の開発がますます期待されています。脂肪肝から肝繊維化に至る過程では、ビタミンA貯蔵細胞である星細胞が多量のコラーゲンを分泌する繊維芽様細胞に分化します。分化によってコラーゲン繊維が大量に分泌されることと、それが蓄積されることが肝繊維化の主な要因であることはよく知られていますが、分泌動態の変化に着目した研究はあまり多くありません。私たちのグループは肝繊維化の際のコラーゲン分泌に着目することで、新たな因子を標的とした新しい肝繊維化治療薬の開発を目指します。
関連した論文等
- Maeda, M., Arakawa, M. and Saito, K. Disease-Associated Factors at the Endoplasmic Reticulum-Golgi Interface.
Traffic, 26(1-3), e70001 (2025) - Maeda, M. and Saito, K. Various methods to detect small GTPase activation: from radioisotope-based methods to the Small GTPase ActIvitY ANalysing (SAIYAN) system.
J. Biochem., 177(5), 321-327 (2025) - Maeda, M. and Saito, K. Methods for Detecting Phosphorylated Proteins and Observing Intracellular Localization During Mitosis.
Methods Mol. Biol., 2874, 153-166 (2025) - Maeda, M., Arakawa, M., Komatsu, Y. and Saito, K. Small GTPase ActIvitY ANalyzing (SAIYAN) system: A method to detect GTPase activation in living cells.
J. Cell Biol.,223(10), e202403179 (2024) - Maeda, M. and Saito, K. p24 family Tango(1) at the endoplasmic reticulum exit site to organize cargo exit.
J. Cell Biol.,223(5), e202403016 (2024) - Saegusa, K., Matsunaga, K., Maeda, M., Saito, K., Izumi, T., and Sato, K. Cargo receptor Surf4 regulates endoplasmic reticulum export of proinsulin in pancreatic β-cells.
Commun Biol., 5 (1), 458 (2022) - Maeda, M., Komatsu, Y and Saito, K. Mitotic ER exit site disassembly and reassembly are regulated by the phosphorylation status of TANGO1.
Dev. Cell 55(2),237-250 (2020) - Maeda, M., Komatsu, Y and Saito, K. Mitotic ER exit site dynamics: insights into blockade of secretion from the ER during mitosis.
Mol. Cell. Oncol. 7(6) 1832420 (2020) - O’Donnell, M.A. People & Ideas, Kota Saito: Getting out and about.
J. Cell Biol. 218(6), 1765-6 (2019) - Centonze, F., Reiterer, V., Nalbach, K., Saito, K., Pawlowski, K., Behrends, C. and Farhan, H. LTK is an ER-resident receptor tyrosine kinase that regulates secretion.
J. Cell Biol.218(8), 2470-80 (2019) - Saito, K. and Maeda, M. Not just a cargo receptor for large cargoes; an emerging role of TANGO1 as an organizer of ER exit sites.
J. Biochem.166(2), 115-9 (2019) - Maeda, M., Kurokawa, K., Katada, T., Nakano, A. and Saito, K. COPII proteins exhibit distinct subdomains within each ER exit site for executing their functions.
Sci. Rep., 9, 7346 (2019) - 齋藤康太 北から南から
生化学 91, 280 (2019) - Ogawa, E., Mukai, K., Saito, K., Arai, H. and Taguchi, T. The binding of TBK1 to STING requires exocytic membrane traffic from the ER.
Biochem. Biophys. Res. Commun.503, 138-145 (2018) - 齋藤康太 高等真核生物における巨大分子分泌機構
生化学 90, 674-682 (2018) - Saito, K., Maeda, M. and Katada, T. Regulation of the Sar1 GTPase Cycle Is Necessary for Large Cargo Secretion from the Endoplasmic Reticulum.
Front. Cell Dev. Biol. 5, 75 (2017) - Tomoishi, S.1, Fukushima, S.1, Shinohara, K., Katada, T. and Saito, K. CREB3L2-mediated expression of Sec23A/Sec24D is involved in hepatic stellate cell activation through ER-Golgi transport. (1Contributed equally)
Sci. Rep., 7, 7992 (2017) - Ge, L., Zhang, M., Kenny, S., Liu, D., Maeda, M., Saito, K., Mathur, A., Xu, K. and Schekman, R. Remodeling of ER-exit sites initiates a membrane supply pathway for autophagosome biogenesis.
EMBO Rep., 18, 1586-1603 (2017) - Maeda, M., Katada, T. and Saito, K. TANGO1 recruits Sec16 to coordinately organize ER exit sites for efficient secretion.
J. Cell Biol., 216 (6), 1731-43 (2017) - Maeda, M., Saito, K., and Katada, T. Distinct isoform-specific complexes of TANGO1 cooperatively facilitate collagen secretion from the endoplasmic reticulum.
Mol. Biol. Cell, 27, 2688-96 (2016) - Tanabe, T., Maeda, M., Saito, K., and Katada, T. Dual function of cTAGE5 in collagen export from the endoplasmic reticulum.
Mol. Biol. Cell, 27, 2008-13 (2016) - Saito, K. and Katada, T. Mechanisms for exporting large-sized cargoes from the endoplasmic reticulum.
Cell. Mol. Life Sci.72 (19), 3709-20. (2015) - Saito, K., Yamashiro, K., Shimazu, N., Tanabe, T., Kontani, K. and Katada, T. Concentration of Sec12 at ER exit sites via interaction with cTAGE5 is required for collagen export.
J. Cell. Biol., 206 (6), 751-62. (2014) - Sasaki, A., Nakae, I., Nagasawa, M., Hashimoto, K., Abe, F., Saito, K., Fukuyama, M., Gengyo-Ando, K., Mitani, S., Katada, T. and Kontani, K. Arl8/ARL-8 functions in apoptotic cell removal by mediating phagolysosome formation in Caenorhabditis elegans.
Mol. Biol. Cell, 24,1584-92. (2013) - Saito, K., Yamashiro, K., Ichikawa, Y., Erlmann, P., Kontani, K., Malhotra, V. and Katada, T. cTAGE5 mediates collagen secretion through interaction with TANGO1 at endoplasmic reticulum exit sites.
Mol. Biol. Cell, 22, 2301-8. (2011) - Saito, K., Chen, M., Bard, F., Chen, S., Zhou, H., Woodley, D., Polischuk, R., Schekman, R. and Malhotra, V. TANGO1 facilitates cargo loading at endoplasmic reticulum exit sites.
Cell, 136, 891-902. (2009) - Bard, F., Casano, L., Mallabiabarrena, A., Wallace, E., Saito, K., Kitayama, H., Guizzunti, G., Hu, Y., Wendler, F., Dasgupta, R., Perrimon, N. and Malhotra, V. Functional genomics reveals genes involved in protein secretion and Golgi organization.
Nature, 439, 604-7. (2006)