INDEX
研究で立証した事象を臨床に還元することを目標として様々な研究を行っています。
得意とする研究技術
脳腫瘍
IDH野生型神経膠腫(こうしゅ)における悪性化機構の解明
IDH野生型神経膠腫は最も頻度が高い悪性髄内腫瘍で、現行の診断基準では全て最悪性のGrade IVに分類されます。一方、臨床的には緩徐増大期の腫瘍が存在し、どのような遺伝子異常を獲得して悪性化するのか、機序は不明です。 本研究では自験例から緩徐増大期のIDH野生型神経膠腫を抽出し、対象症例のFFPE検体を用いて病理画像解析と遺伝子解析を行います。 病理画像解析では細胞密度や核異型性、腫瘍細胞の分散性を定量化し、Grade IVの腫瘍との差を解析します。 遺伝子解析では保存検体からDNAを抽出し、本学分子医学部門の次世代シーケンサーを用いて遺伝子変異の解析を行います。また、ハイブリダイゼーションキャプチャ法を用いて染色体コピー数解析も行い、Grade Ⅳの腫瘍との分子生物学的な差異を明らかにします。
くも膜下出血・脳血管攣縮(れんしゅく)
くも膜下出血後慢性期の脳微細構造変化の検討
脳くも膜下出血の後遺症の1つに高次機能障害があり、これは通常のMRIでは病変が指摘できない場合にもみられ、詳しい原因や予防法は確立していません。また、最近ではMRIの拡散強調画像を用いてくも膜下出血に脳微細構造変化が起きるとの報告があり、高次機能障害が脳微細構造変化と関連している可能性が示唆されています。本研究ではくも膜下出血あるいは未破裂脳動脈瘤の患者さんを対象として、MRIの拡散強調像のデータを収集し、それぞれの脳微細構造の変化と、高次機能を含む神経症状や就労状況との関連性の解析をすすめております。 本研究によりくも膜下出血後の神経機能に関連する因子が明らかとなれば、多くの患者さんで的確な治療選択に役立つと考えられます。
脳静脈洞血栓症モデル
脳静脈洞血栓症モデル作成、病理組織学的な検討
脳脳静脈(洞)血栓症は脳卒中の約1%と稀な疾患でありますが、
若年者や妊婦に多く、脳外科手術の合併症として生じることもあり、臨床的インパクトが大きい疾患です。
動物モデルによる研究もありますが、再現性や必ずしもヒト病態を反映していないなど、
解決しなければならない問題点も多く残されています。そのため、より臨床に近く簡便で再現性あるモデルを用いた詳細な病態研究が望まれています。
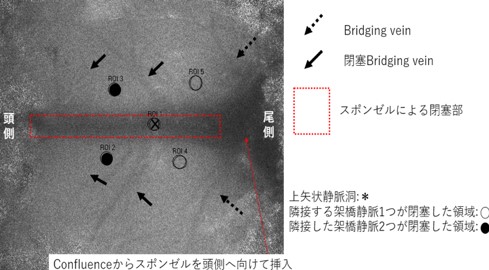
今回我々はこれまでにラットの上矢状静脈洞(superior sagittal sinus:SSS)の閉塞長を可変できるモデルを独自に開発することに成功しました。
脳静脈(洞)血栓症による脳血流低下の程度は閉塞する架橋静脈の本数に影響されることが報告されており(Nakase et al. Journal of Neurosurgery 1995)、
SSS及びSSSに流入する架橋静脈の位置、本数を確認し、計画した数の架橋静脈を閉塞するよう塞栓子をSSS内に留置することで、様々な程度の静脈洞血栓症を作成します。
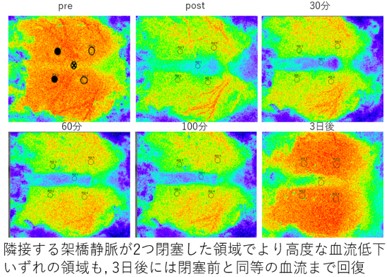
これによる脳血流の変化はLaser speckle flowmetry(LSF)でリアルタイムに把握できるため、脳血流低下程度と相関させつつ解析することで軽度から重度にわたる静脈性虚血障害を人為的に作成することが可能となりました。
本研究ではLSFを用いて脳血流の変化を時間的・空間的に把握しつつ、対応する脳組織においては、軽度の脳血流低下でも影響をうけると思われるneurovascular unit(NVU)に焦点をあて、その変化を明らかにすることによって脳静脈(洞)血栓症の病態解明に迫ります。
その上で、抗凝固、抗炎症などの薬物療法の効果を検証します。本研究により病態に基づいた治療アプローチを確立できれば、脳静脈洞血栓症診療が大きく変わるのみならず、手術の安全性向上にも寄与し社会的貢献が大きいと考えられます。
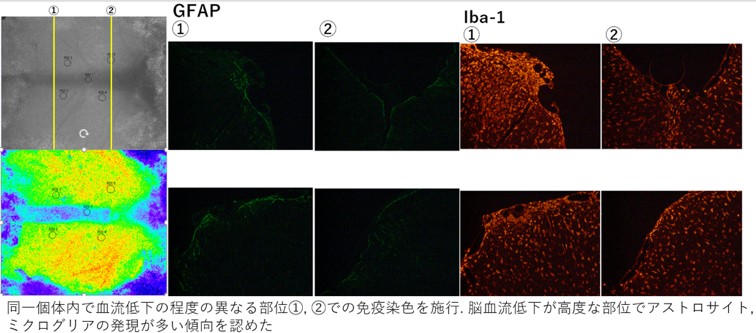
上述のモデルを使い、蛋白の定量・局在決定に免疫組織染色と共焦点レーザー顕微鏡による観察、Western blot法、細胞外アミノ酸濃度の測定にin situ hybridization法を用いています。 また、脳・脊髄内の酸化ストレス評価法としてhydroethidine法、組織内のDNA損傷評価にはTUNEL法、ssDNA法を行っています。また、運動学的評価はラット/マウス用歩行装置を用いたビデオ解析を行っています。
慢性脳低灌流後血行再建モデル
慢性脳低灌流後血行再建モデルの作成、病理組織学的な検討
頚部頚動脈狭窄症、脳主幹動脈閉塞症やもやもや病は、術前の脳循環不全(安静時血流低下、循環予備能低下)が高度な場合、血行再建術により脳梗塞発症予防効果が期待できます。しかしながら、高度脳循環不全では脳動脈の自動調節能が障害され、術後に血圧依存性の過灌流をきたし、著しい場合、重篤な脳出血をきたす場合があります。脳出血が発生した場合の死亡率は36-63%まで達するとされ、 重要な予後規定因子となります。こうした慢性脳虚血に対する血行再建術後早期におこる過灌流の発生機序は未だ明らかにされておらず、従って確実な予防や治療も確立していません。その問題として、この病態を研究するのに適した動物モデルがないことが挙げられます。 本研究は過灌流モデルを作成することで、その病態の解明を目的としております。
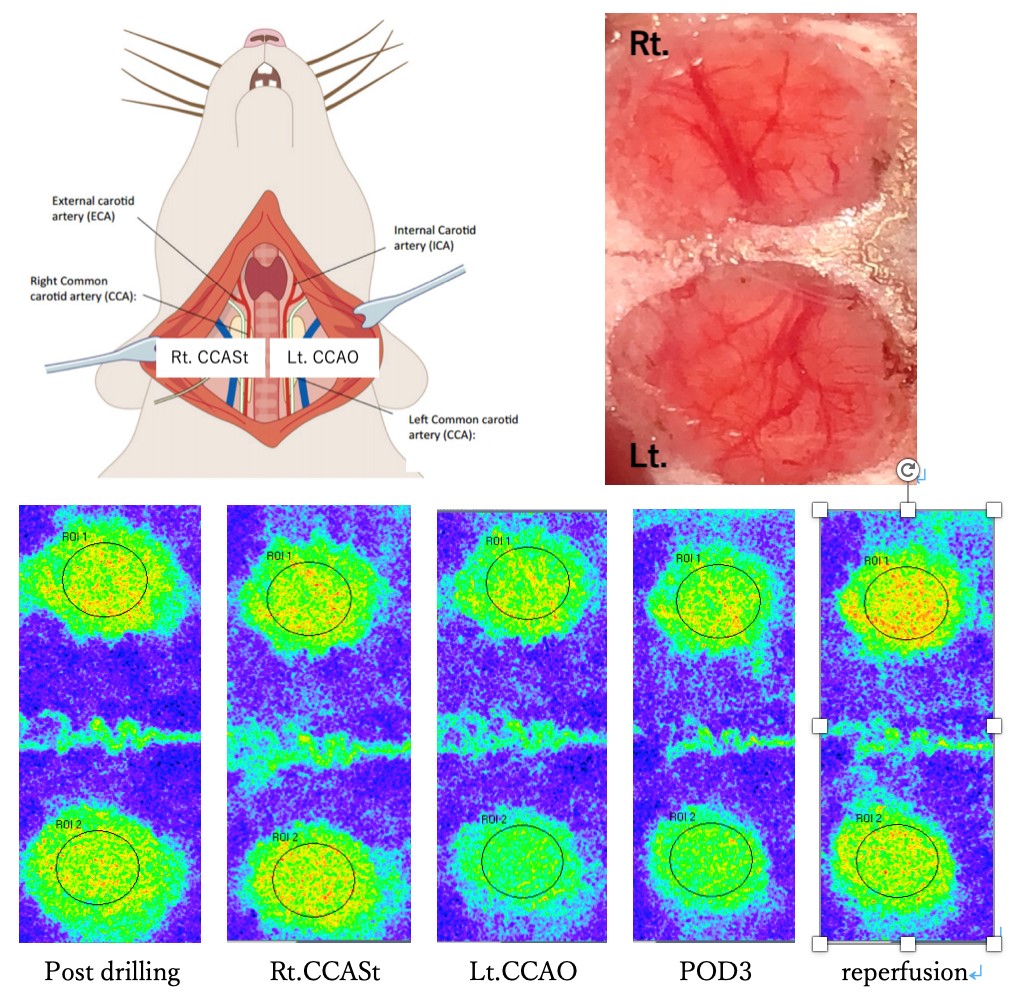
メスSDラットの左内頚動脈を結紮し、また右内頚動脈を29G針と共に結紮し、針を直ちに抜去して狭窄させ、慢性虚血を作成し、3日後に狭窄を解除して過灌流を観察します。過灌流から1日後、2日後、3日後でlaser speckle flowmetryで脳血流を測定します。 その後抜脳し、脳組織学的検討を行います。現在、当講座では血管周囲細胞と血管内皮細胞に注目しています。血管周囲細胞と過灌流との関係は明確ではありませんが、血液脳関門の機能障害により過灌流が起こるとの報告があり(Bell et al, Nature.2012)、その血液脳関門の構造維持には血管周囲細胞が重要な役割を果たしていることから、過灌流の機序にpericyteの機能障害が関与している可能性がありますが、十分には検討なされていません。 また、自動調節能は血管内皮を中心とした生理機能でもたらされることや、血行再建術中にフリーラジカルスカベンジャー(エダラボン)を投与すると術後の過灌流がある程度予防できることなどから、血管内皮が関係している可能性がありますが、こちらも十分な検討はなされておりません。そのため、それぞれに対する免疫化学染色を行っています。また、形態解析学・器官構造学講座様と神経解剖学・神経病理学の分野について実験協力をいただいております。