エピゲノムと生活習慣病
はじめに
私たちの生活環境や習慣はエピゲノムを後天的に書き換え、体質や病気への感受性を変化させます。また、生活環境や習慣は本人だけでなく、将来生まれてくる子にも影響することが近年分かってきています。
私たちの研究グループではエピゲノムに着目して、環境要因が生命現象および疾患発症を調節する仕組みを解明し、新しい生活習慣病の予防・治療法の開発につなげることを目指しています。
脂肪燃焼・蓄積体質とエピゲノムの研究
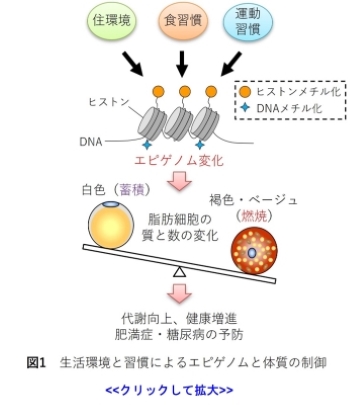 遺伝情報にはゲノムとエピゲノムがあります。両親から授かったゲノムDNAの配列は基本的に変わりません。
しかし、生活環境や習慣によってエピゲノムは後天的に書き換わります。
代表的なエピゲノムとして、DNAのメチル化やDNAを巻き取る役割を持つヒストンタンパク質のメチル化やアセチルが知られています。
遺伝情報にはゲノムとエピゲノムがあります。両親から授かったゲノムDNAの配列は基本的に変わりません。
しかし、生活環境や習慣によってエピゲノムは後天的に書き換わります。
代表的なエピゲノムとして、DNAのメチル化やDNAを巻き取る役割を持つヒストンタンパク質のメチル化やアセチルが知られています。
脂肪細胞には脂肪を蓄える白色脂肪細胞と、脂肪を燃やす褐色およびベージュ脂肪細胞があります (1)。
褐色・ベージュ脂肪細胞は糖や脂肪を活発に代謝し、エネルギーを消費することから、肥満症の予防だけでなく健康・美容の観点からも着目されています。
これまでの研究で、生活環境や習慣がどのように脂肪細胞のエピゲノムを書き換え、脂肪を蓄積しやすい、あるいは燃焼しやすい体質を作るのかが、徐々に明らかになってきています (図1)(2, 3)。
寒さが苦手な方も多いかと思いますが、実のところ寒さ刺激を持続的に受けると、脂肪細胞のエピゲノムが書き換わり、脂肪を燃焼しやすい体質が得られるのです (4-8)。
当研究室では、住環境、食習慣、運動習慣がエピゲノムを変える仕組みについてさらに研究を進めています。そして、研究で得られた知見を、代謝向上と病気になりにくい健康な身体づくりに役立てたいと考えています。
世代を超えて伝わる体質とエピゲノムの研究
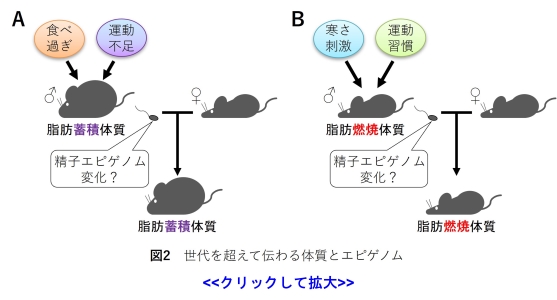
近年、父親の生活環境や習慣は本人だけではなく、将来生まれてくる子の代謝に影響することが分かってきました。
父親の悪い生活習慣(偏った食事や運動不足)は子に脂肪蓄積体質を伝え、代謝性疾患のリスクを上げることが報告されています(図2A) (9-12)。
一方で、父親の良い生活環境や習慣(寒さ刺激や適度な運動)は子に脂肪燃焼体質を伝え、代謝性疾患のリスクを下げることが報告されています(図2B)(11-13)。
しかし、「父親の生活環境や習慣がなぜ子に体質として伝わるのか?」その仕組みは不明な点が多く残されています。
当研究室では、精子のDNAメチル化や小分子RNAの解析を行うことで、世代を超えて伝わる体質の仕組みをエピゲノムの観点から明らかにしたいと考えています。
世代を超えた代謝制御の研究を通じて、現在そして未来の国民の健康に貢献することを目指しています。
エピゲノムとエピトランスクリプトームの相互制御に関する研究
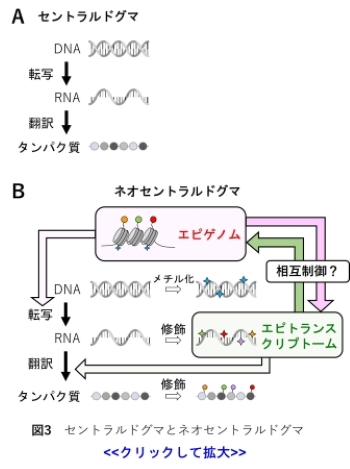 分子生物学のセントラルドグマでは、DNAからRNAが転写され、RNAからタンパク質が翻訳されます。これらの過程を経て、遺伝子の機能が発現します(図3A)。
DNAメチル化やヒストンタンパク質の化学修飾はエピゲノムであり、これらエピゲノムはDNAからRNAの転写の過程を調節します。
一方、RNAも様々な化学修飾を受け、RNAの修飾を総称してエピトランスクリプトームと呼びます。
RNAの修飾は、RNAの局在や安定性に加え、タンパク質への翻訳効率を制御することで、遺伝子発現を調節することが分かっています。
従来エピゲノムとエピトランスクリプトームは、異なるレイヤーで遺伝子発現を調節すると考えられていました。
しかし、近年エピゲノムがエピトランクリプトームを、エピトランスクリプトームがエピゲノムを制御することが示唆されています (14-17)。
当研究室では、エピゲノムとエピトランスクリプトームの相互制御を解析することで、遺伝子発現における新概念「ネオセントラルドグマ」に迫りたいと考えています(図3B)。
分子生物学のセントラルドグマでは、DNAからRNAが転写され、RNAからタンパク質が翻訳されます。これらの過程を経て、遺伝子の機能が発現します(図3A)。
DNAメチル化やヒストンタンパク質の化学修飾はエピゲノムであり、これらエピゲノムはDNAからRNAの転写の過程を調節します。
一方、RNAも様々な化学修飾を受け、RNAの修飾を総称してエピトランスクリプトームと呼びます。
RNAの修飾は、RNAの局在や安定性に加え、タンパク質への翻訳効率を制御することで、遺伝子発現を調節することが分かっています。
従来エピゲノムとエピトランスクリプトームは、異なるレイヤーで遺伝子発現を調節すると考えられていました。
しかし、近年エピゲノムがエピトランクリプトームを、エピトランスクリプトームがエピゲノムを制御することが示唆されています (14-17)。
当研究室では、エピゲノムとエピトランスクリプトームの相互制御を解析することで、遺伝子発現における新概念「ネオセントラルドグマ」に迫りたいと考えています(図3B)。
微生物由来の生物活性物質の探索とケミカルバイオロジー研究
はじめに
微生物は私たち人類の暮らしを豊かにしてきました。食品・酒類生産に加えて代表的なものの一つが医薬品開発です。ペニシリンを代表する抗生物質の開発から始まった微生物由来の医薬品開発は、抗がん剤、コレステロール低下薬、免疫抑制剤といった様々な生物活性を示す医薬品を生み出してきました。
私たちの研究グループは、微生物が生み出す多様な二次代謝産物の中から新しい生物活性物質を探索し、新しい医薬品開発へつなげることを目的に研究を行っています。
線溶賦活化物質に関する研究
現在、本邦の死因順位の2位は心疾患、4位は脳血管疾患であり、これらを誘引する血栓性疾患の治療ならびに予防は世界的に見てもきわめて重要です。血栓性疾患の治療に使用される血栓溶解剤は、血管内の線溶系を亢進させ、形成された血栓の分解を引き起こします。線溶系とは、血液中に存在する不活性型酵素のプラスミノゲンがその活性化因子である組織型プラスミノゲンアクチベータ(tPA)やウロキナーゼ型プラスミノゲンアクチベータ(uPA)といったセリンプロテアーゼによって活性型のプラスミンへと変換し、血栓の主成分であるフィブリンの分解を引き起こす血管の恒常性を維持する内在性のシステムです。
線溶系を亢進させる血栓溶解療法には外来性のtPAやuPAといったプラスミノゲン活性化因子が酵素製剤として現在臨床利用されていますが、血中の短い半減期、大量投与の必要性、全身性の出血傾向、緊急治療に限定、長期投与が不可といった多くの課題が問題となっています。
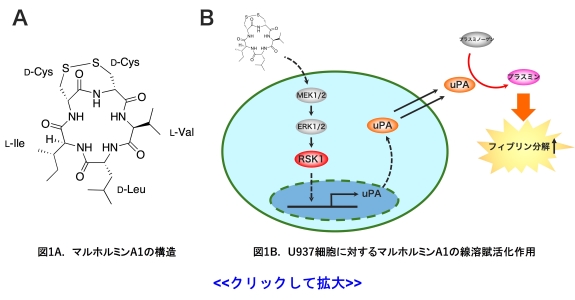
私たちは血栓溶解剤の開発を目的とした線溶活性促進化合物の探索過程において、糸状菌が生産する低分子型環状ペプチド化合物のマルホルミンA1を発見しました (図1A) (1)
。作用メカニズムの解析から、マルホルミンは数μMの濃度で線溶系のモデル細胞であるU937単球細胞が生産するuPAを介したプラスミノゲンの活性化を亢進させること (1, 2)
、さらにMAPK経路の活性化を介してuPAの遺伝子発現を上昇させた結果、線溶活性を促進させることなど (3)
、既存の酵素製剤とは異なる作用メカニズムで線溶系を亢進させることを明らかにしてきました (図1B)
。現在、血管内における主要なuPA産生組織である血管内皮細胞に対するマルホルミンの影響について検証を進めています。
また、新たなuPA活性誘導化合物の探索を他機関との共同研究により進めており、スクリーニングの結果からこれまでに数種類の微生物由来の二次代謝産物を見出しています。
抗菌活性物質の探索研究
近年、多くの国で抗菌薬の効かない薬剤耐性菌の増加が問題となっています。2004年に秋田大学附属病院においてもMRSA(メチシリン耐性黄色ブドウ球菌)及びVRE(バンコマイシン耐性腸球菌)のアウトブレイクが起きたことも記憶に新しい事例です。一方、新規抗菌薬開発は減少傾向にあります。その理由として、慢性疾患の治療薬と比べ、投与期間が短い抗菌薬は製薬企業にとって利益を生みにくい薬剤となっており、抗菌薬の開発から撤退が進み、新しく承認される抗菌薬がほとんど出てこないことが挙げられます。このような状況下において、アカデミアや公設施からの新しい抗菌薬の開発が望まれています。
私たちは新しい抗菌物質の探索を目的に、秋田県内の土壌から分離した糸状菌や放線菌といった微生物の培養抽出液を対象としたスクリーニングを行いました。その結果、仙北市の河川の堆積土砂から分離した放線菌
Streptomyces
sp.
AUMR0230株の培養抽出液から、ストレプトグラミン系抗生物質グループBに属する環状デプシペプチドのエタマイシンAを見出しました (図2) (4,
5) 。エタマイシンAはグラム陽性細菌に効果的な抗菌活性を示し、病院感染の現場で多く遭遇されるメチシリン耐性表皮ブドウ球菌 S.
epidermidis(MRSE)に対しても強い抗菌活性を示しました(最小発育阻止濃度MIC:1
μg/ml)。さらに、ストレプトグラミン系抗生物質グループAに属するグリセオビリジンとの併用により、MRSEに対する相乗効果を示しました。今回の結果から、エタマイシンAがMRSEに対して有効なストレプトグラミン系抗生物質であることが明らかとなりました。
また、現在も秋田県の土壌由来の微生物を活用した抗菌活性スクリーニングを進めており、数種類の微生物が抗菌物質を生産していることを見出しています。
褐色脂肪細胞活性化物質の探索研究
近年、食の欧米化に伴い、日本においても肥満者が増加傾向にあります。肥満は糖尿病、高血圧、脂質異常症といった生活習慣病と密接に関わっており、その悪化は動脈硬化のリスクを増加させます。そのような肥満に対する新しい治療法の開発が早急な課題となっています。脂肪組織には、エネルギーを貯蔵する白色脂肪組織とエネルギーを消費する褐色脂肪組織が存在します。エネルギーを消費して、熱産生を引き起こす褐色脂肪組織の活性化は抗肥満対策の一つと考えられています。
現在、私たちは褐色脂肪細胞の熱産生に関わるミトコンドリア脱共役タンパク質1(UCP1)の発現レベルを指標とした褐色脂肪細胞活性化評価系を立ち上げています(図3)。今後、本評価系を活用したスクリーニングによって、褐色脂肪細胞の熱産性能を活性化させる新しい抗肥満薬の開発が期待されます。
がんの悪性化
はじめに
がんは世界の死亡の主たる原因の一つで、日本では毎年がんで亡くなる患者数は全死亡者の約3割を占めています。様々な治療法の開発によりがん患者の予後は良くなっていますが、がんは進行状況により悪性化する場合があります。悪性化したがん細胞は浸潤能・転移能を獲得し、これが患者の予後不良につながる大きな問題となっています。私たちの研究グループは、がん悪性化の仕組みを解明し、新しいがん治療法の開発へつなげることを目的に研究を行っています。
がんと免疫の相互作用の研究
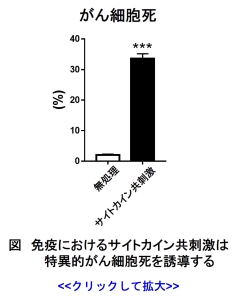 がんの排除機構として免疫系の活性化が不可欠であり、これまでマウス腫瘍モデルを用いた研究から、がんの悪性化は免疫抑制と関連していることが明らかとなり、免疫抑制環境に適応したがん細胞は様々な機構を介して、悪性化を促進させることが明らかとなってきました。
がんの排除機構として免疫系の活性化が不可欠であり、これまでマウス腫瘍モデルを用いた研究から、がんの悪性化は免疫抑制と関連していることが明らかとなり、免疫抑制環境に適応したがん細胞は様々な機構を介して、悪性化を促進させることが明らかとなってきました。
当研究室では、がんと免疫系の相互作用を研究しており、その一環として、サイトカイン刺激による特異的がん細胞死を見出し
(図)、そのメカニズムの解析を進めています。
参考文献
エピゲノムと生活習慣病
- Matsumura Y, Osborne TF, Sakai J.
Epigenetic and environmental regulation of adipocyte function.
J Biochem (2022) 172, 9-16. - Matsumura Y, Ito R, Yajima A, Yamaguchi R, Tanaka T, Kawamura
T,
Magoori K, Abe Y, Uchida A, Yoneshiro T, Hirakawa H, Zhang J, Arai M, Yang C, Yang G,
Takahashi H, Fujihashi H, Nakaki R, Yamamoto S, Ota S, Tsutsumi S, Inoue SI, Kimura H, Wada
Y, Kodama T, Inagaki T, Osborne TF, Aburatani H, Node K, Sakai J.
H3K4/H3K9me3 Bivalent Chromatin Domains Targeted by Lineage-Specific DNA Methylation Pauses Adipocyte Differentiation.
Mol Cell (2015) 60, 584-596. - Matsumura Y, Nakaki R, Inagaki T, Yoshida A, Kano Y, Kimura H,
Tanaka T, Tsutsumi S, Nakao M, Doi T, Fukami K, Osborne TF, Kodama T, Aburatani H, Sakai
J.
Spatiotemporal dynamics of SETD5-containing NCoR-HDAC3 complex determines enhancer activation for adipogenesis.
Nat Commun (2021) 12, 7045. - Abe Y, Rozqie R, Matsumura Y, Kawamura T, Nakaki R, Tsurutani
Y,
Tanimura-Inagaki K, Shiono A, Magoori K, Nakamura K, Ogi S, Kajimura S, Kimura H, Tanaka T,
Fukami K, Osborne TF, Kodama T, Aburatani H, Inagaki T, Sakai J.
JMJD1A is a signal-sensing scaffold that regulates acute chromatin dynamics via SWI/SNF association for thermogenesis.
Nat Commun (2015) 6, 7052. - Abe Y, Fujiwara Y, Takahashi H, Matsumura Y, Sawada T, Jiang S,
Nakaki R, Uchida A, Nagao N, Naito M, Kajimura S, Kimura H, Osborne TF, Aburatani H, Kodama
T, Inagaki T, Sakai J.
Histone demethylase JMJD1A coordinates acute and chronic adaptation to cold stress via thermogenic phospho-switch.
Nat Commun (2018) 9, 1566. - Takahashi H, Yang G, Yoneshiro T, Abe Y, Ito R, Yang C, Nakazono J,
Okamoto-Katsuyama M, Uchida A, Arai M, Jin H, Choi H, Tumenjargal M, Xie S, Zhang J, Sagae
H, Zhao Y, Yamaguchi R, Nomura Y, Shimizu Y, Yamada K, Yasuda S, Kimura H, Tanaka T, Wada Y,
Kodama T, Aburatani H, Zhu MS, Inagaki T, Osborne TF, Kawamura T, Ishihama Y,
Matsumura Y, Sakai J.
MYPT1-PP1β phosphatase negatively regulates both chromatin landscape and co-activator recruitment for beige adipogenesis.
Nat Commun (2022) 13, 5715. - Ito R, Xie S, Tumenjargal M, Sugahara Y, Yang C, Takahashi H, Arai M, Inoue SI,
Uchida A, Nakano K, Choi H, Yang G, Zhao Y, Yamaguchi R, Jin H, Sagae H, Wada Y, Tanaka T,
Kimura H, Kodama T, Aburatani H, Takeda K, Inagaki T, Osborne TF, Yoneshiro T,
Matsumura Y, Sakai J.
Mitochondrial biogenesis in white adipose tissue mediated by JMJD1A-PGC-1 axis limits age-related metabolic disease.
iScience (2024) 27, 109398. - Takahashi H, Ito R, Matsumura Y, Sakai J.
Environmental factor reversibly determines cellular identity through opposing Integrators that unify epigenetic and transcriptional pathways.
Bioessays (2024) 46, e2300084. - Sharma U, Conine CC, Shea JM, Boskovic A, Derr AG, Bing XY, Belleannee C,
Kucukural A, Serra RW, Sun F, Song L, Carone BR, Ricci EP, Li XZ, Fauquier L, Moore MJ,
Sullivan R, Mello CC, Garber M, Rando OJ.
Environmental factor reversibly determines cellular identity through opposing Integrators that unify epigenetic and transcriptional pathways.
Science (2016) 351, 391-396. - Chen Q, Yan M, Cao Z, Li X, Zhang Y, Shi J, Feng GH, Peng H, Zhang X, Zhang Y,
Qian J, Duan E, Zhai Q, Zhou Q.
Sperm tsRNAs contribute to intergenerational inheritance of an acquired metabolic disorder.
Science (2016) 351, 397-400. - Barrès R, Zierath JR.
The role of diet and exercise in the transgenerational epigenetic landscape of T2DM.
Nat Rev Endocrinol (2016) 12, 441-451. - Kusuyama J, Alves-Wagner AB, Makarewicz NS, Goodyear LJ.
Effects of maternal and paternal exercise on offspring metabolism.
Nat Metab (2020) 2, 858-872. - Sun W, Dong H, Becker AS, Dapito DH, Modica S, Grandl G, Opitz L, Efthymiou V,
Straub LG, Sarker G, Balaz M, Balazova L, Perdikari A, Kiehlmann E, Bacanovic S, Zellweger
C, Peleg-Raibstein D, Pelczar P, Reik W, Burger IA, von Meyenn F, Wolfrum C.
Cold-induced epigenetic programming of the sperm enhances brown adipose tissue activity in the offspring.
Nat Med (2018) 24, 1372-1383. - Huang H, Weng H, Zhou K, Wu T, Zhao BS, Sun M, Chen Z, Deng X, Xiao G, Auer F,
Klemm L, Wu H, Zuo Z, Qin X, Dong Y, Zhou Y, Qin H, Tao S, Du J, Liu J, Lu Z, Yin H,
Mesquita A, Yuan CL, Hu YC, Sun W, Su R, Dong L, Shen C, Li C, Qing Y, Jiang X, Wu X, Sun M,
Guan JL, Qu L, Wei M, Müschen M, Huang G, He C, Yang J, Chen J.
Histone H3 trimethylation at lysine 36 guides m6A RNA modification co-transcriptionally.
Nature (2019) 567, 414-419. - Murakami S, Jaffrey SR.
Hidden codes in mRNA: Control of gene expression by m(6)A.
Mol Cell (2022) 82, 2236-2251. - Kan RL, Chen J, Sallam T.
Crosstalk between epitranscriptomic and epigenetic mechanisms in gene regulation.
Trends Genet (2022) 38, 182-193. - Matsumura Y, Wei FY, Sakai J.
Epitranscriptomics in metabolic disease.
Nat Metab (2023) 5, 370-384.
微生物由来の生物活性物質の探索とケミカルバイオロジー研究
- Koizumi Y, Hasumi K.
Enhancement of fibrinolytic activity of U937 cells by malformin A1.
J Antibiot (2002) 55, 78-82. - Koizumi Y, Fukudome H, Hasumi K.
Fibrinolytic activation promoted by the cyclopentapeptide malformin: involvement of cytoskeletal reorganization.
Biol Pharm Bull (2011) 34, 1426-1431. - Koizumi Y, Nagai K, Gao L, Koyota S, Yamaguchi T, Natsui M,
Imai Y, Hasumi K, Sugiyama T, Kuba K.
Involvement of RSK1 activation in malformin-enhanced cellular fibrinolytic activity.
Sci Rep (2018) 8, 5472. - Heinemann B, Gourevitch A, Lein J, Johnson DL, Kaplan MA, Vanas D, Hooper
IR.
Etamycin, a new antibiotic.
Antibiot Annu (1954) 2, 728-732. - Sheehan JC, Zachau HG, Lawson WB.
The structure of etamycin.
J Am Chem Soc (1958) 80, 3349-3355.
