脊髄損傷に対する神経再生医療『ステミラック®注』を用いた診療について
当院整形外科は脊髄損傷に対して、再生医療等製品『ステミラック®注(一般的名称:ヒト(自己)骨髄由来間葉系幹細胞)』を用いた脊髄再生医療を行っております。この治療は限られた施設でしか行うことができませんが、当院は、2020年に札幌医科大学に次いで日本で2番目にステミラック注治療を開始した施設です。
これまで、他県からヘリコプターなどで脊髄損傷患者さんを受け入れたこともあり、2023年までに13例の治療実績があります。今後も東北全域からの脊髄損傷患者を秋田で治療することが見込まれています。
※患者さん及びご家族からの直接の治療申し込みは行っておりません。必ず、入院中の医療機関の主治医に当院への紹介をご依頼くださりますよう、よろしくお願いいたします。
お問い合わせについて
ステミラック注は、受傷後31日以内の骨髄液採取が定められているため、できる限り迅速なお問い合わせをお願いしております。患者さんの紹介を希望される主治医様は、下記の患者紹介フォームをダウンロードしていただき、治療担当医師までご連絡くださいますよう、よろしくお願いいたします。
お問い合わせの流れ

治療担当医師
- 宮腰尚久(Naohisa Miyakoshi)
- 粕川雄司(Yuji Kasukawa)
- 工藤大輔(Daisuke Kudo)
- 木村竜太(Ryota Kimura)
- 尾野祐一(Yuichi Ono)
患者さん及びご家族からの直接の治療申し込みは行っておりません。必ず、入院中の医療機関の主治医に当院への紹介をご依頼ください。
患者さん紹介フォーム
ステミラック注を用いた脊髄損傷再生医療の患者さんの紹介を希望される主治医様は、以下のページから要事項を入力の上、専用の患者さん紹介フォームを送付くださいますようお願いいたします。
→患者紹介フォームはこちら(新規ウィンドウで開きます。)
再生医療等製品『ステミラック®注』とは
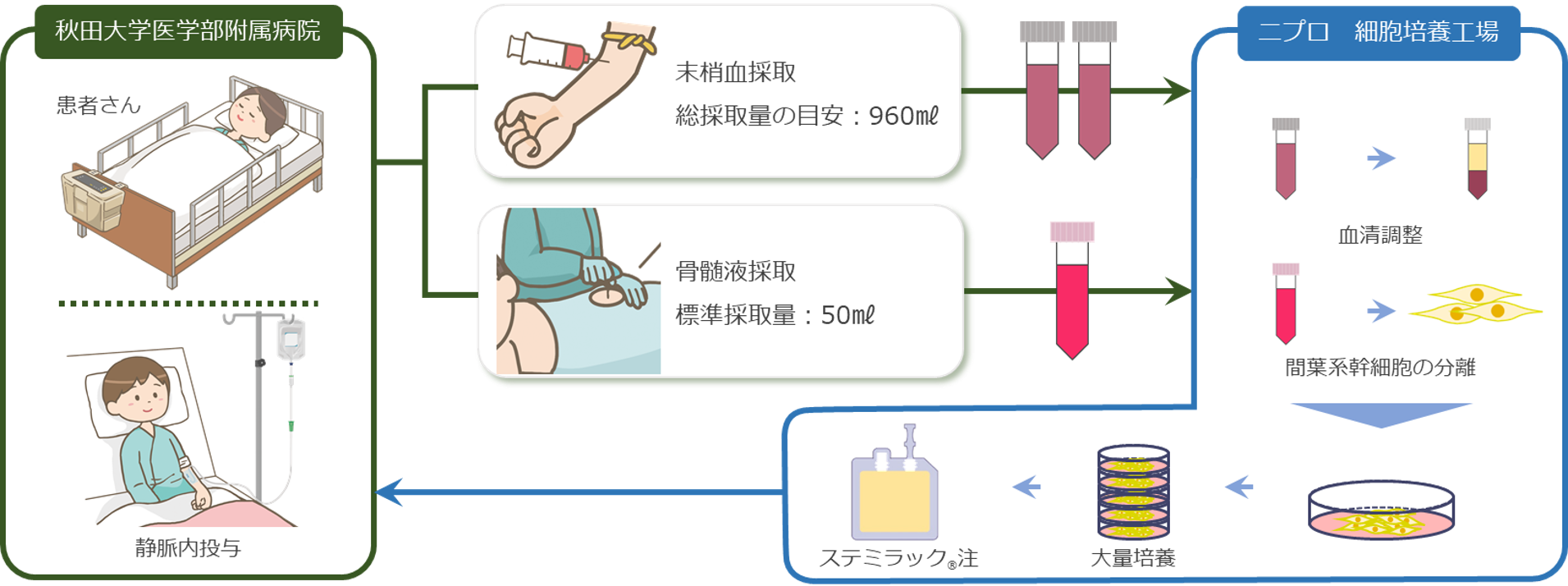
ステミラック®注は、患者さんから採取した骨髄液中の間葉系幹細胞(自己骨髄間葉系幹細胞)を体外で培養・増殖させた再生医療等製品です。培養液中には、患者さんの血清を用いるため、ステミラック®注の原材料は、患者さんご自身の末梢血及び骨髄液となります。培養後の間葉系幹細胞を、患者さんの末梢静脈内に点滴静注を行うことで体内へ戻し、脊髄損傷による機能障害の改善を図ります。
治療の流れ
適応疾患および適格基準
適応疾患:
外傷性脊髄損傷で、ASIA機能障害尺度がA, BまたはCの方
※原材料採取が可能であれば、年齢や損傷高位にかかわらず、本治療の適応をご相談ください。
適格基準:
①骨髄液の採取を、脊髄損傷受傷後31日以内を目安に実施できる方
※培養の準備のため、受傷後約2週間以内の転院が必要です。
②以下に該当しない方
- 本品の成分に対して過敏症の既往歴
- 悪性腫瘍の合併又は既往
- アレルギーの素因
- 感染症を合併
- 体重が低い方(特に小児)や貧血
- 全身状態が極めて不良(例:内分泌代謝疾患、循環器疾患、呼吸器系の 疾患、消化器系の疾患、重度の多発性外傷、多臓器障害等)
- 重度の頭蓋内病変、主要血管の高度狭窄、解離性大動脈瘤、強い動脈硬化性変化、重度の石灰化等を認める
- 重度の脊髄・脊椎疾患(骨粗鬆症、脊髄腫瘍、脊髄血管奇形、脊髄空洞症等)を認める
- 血圧を収縮期140 mmHg以下、拡張期90 mmHg以下にコントロールすることができない
- その他医師が不適切と判断した方
※適格性判断に際して、詳細な全身スクリーニング検査を実施いたします。投与に不適切と判断される併存症、合併症が認められた場合には治療を受けられません。

