一般講演1
ラットの血糖値におよぼすエーテルと採血の影響
○ 遊佐 寿恵、片平 清昭(福島医大・実験動物研究施設)
これまで我々は、マウス・ラットの血糖値に及ぼす麻酔の影響について検討しており、エーテルは血糖値の上昇率が大きくネンブタールでは
小さいことを確認した。麻酔薬投与後の血糖値の変化率(平均値と標準偏差)>はペントバルビタールで118.0±11.4%、エーテルの場合は143.4±20.3%であった。
エーテル麻酔の際はデシケータにエーテルを充満させラットを麻酔したが、一台のデシケータに順次ラットを入れた。そのためにデシケータ内の炭酸ガスが次の
ラット麻酔に影響している懸念が指摘された。今回はデシケータ内のエーテルが同じ濃度になるように条件を整えた。また、麻酔薬投与の影響を検討する際には、
1匹のラットを投与前と後の2回採血し、1回目の採血処置によるストレスが2回目の血糖値上昇に影響しているかを検討した。
供試動物は15〜19週齢のJcl:Wistar(オス)9匹、血糖値測定は簡易血糖測定器((株)三和化学研究所製、グルテストエース) を用いた。
ラットに吸入させるエーテルの濃度を一定にするために4Lのデシケータにエーテルを20mlいれ、麻酔時間を約2分とした。また、採血処置の影響を確認 する際はラットを
保定、1回目の採血から20分後に2回目の採血を行った。尾部静脈内に注射針を挿入し自然に漏出する血液をグルテストエースのセンサー部に吸引 させ微量全血を検体
として測定した。
エーテル投与前の血糖値は71.2±6.22mg/dl投与後は98.7±13.10mg/dlであり、投与後の上昇率は138.8±15.92%であった。これは以前に
我々がエーテル麻酔により約140%上昇すると確認した値と同程度である。
また、採血1回目と2回目の血糖値はそれぞれ71.6±5.36mg/dl、81.3±5.68mg/dlであり、2回目が有意に(P<0.01)上昇した。
1回目の血糖値を基準としたときの2回目の血糖値の変化率は113.8±5.51%であった。これは生理食塩水を腹腔内に投与した場合の血糖値の上昇率と同程度である。
これまでペントバルビタール麻酔後の血糖値の上昇は採血処置によるストレス(痛み?)が影響していたものと推察される。
以上のことからエーテル麻酔は尾静脈穿刺、生理食塩水腹腔内投与、ペントバルビタール麻酔と比較すると血糖値に及ぼす影響が大きい。
また、実験処置がラットの血糖値に及ぼす影響も無視できず、ラットに与えるストレスを少なくし誤差変動を小さくするよう努める必要がある。
一般講演2
ラットにおける不定期照明延長の血球変動について(その2)
○馬場秀明、今井信子、葛西律子、工藤 均、八木澤 誠(弘前大学医学部附属動物実験施設)
当施設では飼育室の照明が、タイマーによる自動照明で、朝8:00〜夜8:00の12時間照明に設定されている。
実験者の中には夜8:00以降に出入りし、手動で照明を付け、実験終了後もそのままの状態で朝まで照明が付いたままの時もまれにある。
動物の飼育管理にあたって、照明が非常に大事であり、照明リズムが崩れた場合には動物の生理的リズムが狂うため、朝、見回りの時に照明
タイマーを 確認するのが日課の一つである。
昨年12月の合同勉強会で不定期照明の血球変動について途中経過を報告し、36時間連続明るい飼育室と、36長時間暗い飼育室では、
血球数の変動に影響を与えることを報告した。今回は引き続きラットを使い、12時間毎の通常照明、48時間の長時間不定期な照明で飼育管理した場合のラット
に与える影響についての血球数の変動を報告する。
【材料:方法】
- ラット:市販のSD♂7週令を使用 各群3匹、計9匹
- 対照群:飼育室の照明を(午前8:00〜午後8:00)12時間通常照明である
- 1群:飼育室の照明を48時間連続明るく設定
- 2群:飼育室の照明を48時間連続暗く設定
- 測定前に体重測定を行う
- 採血時間:前・6・12・24・36・48(時間)6回行う
- 採血方法:エーテル麻酔・保定後に頸静脈から0.3ml採血
- 測定項目:体重・RBC・WBC・Ht・Hg
- 測定機材:SystemxF#65293;520使用
【結 果】
- 通常照明においてはあまり血球数の変動に影響がないことがわかった。
- 48時間連続明るい飼育室と、暗い飼育室では、血球数の変動に異常と見られる影響が与えていることがわかった。
一般講演3
3種蟯虫卵の鑑別法
○今井信子、馬場秀明、葛西律子、工藤 均、八木澤 誠(弘前大学医学部附属動物実験施設)
今年3月、当施設のモニターラットから蟯虫が検出された。他の飼育室汚染状況を調査するため、マウス・ラット飼育室
をランダムに調査した結果、かなりの飼育室が汚染され、3種類の蟯虫が寄生していることがわかった。全飼育室の汚染状況を把握するため、
効果的な蟯虫卵検出法の検討を行ったので報告する。
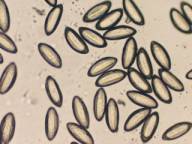
Syphacia obvelata、Syphacia muris
Syphacia murisはマウス、S.murisはラットから検出された。共にセロハンテープ法で、午後1時頃
検査するのが、検出率が高く、検出数も多かった。虫卵の大きさは平均125.6×28.3μm、74.3×26.5μmと明らかに異なり、両種の鑑別は容易である。
S.obvelata 虫卵
 | |
S.muris虫 卵
 |
|
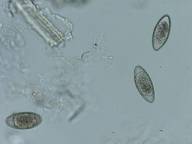
Aspiculuris tetraptera
マウスから検出され、虫卵の大きさは平均84.3×36.1μmである。検査は朝とれた糞便を硫苦食塩水浮遊法での検査が検出率、
数ともに多かった。
A. tetraptera 虫卵
 | |
浮遊法
 |
|
一般講演4
当部門における4年間の検疫状況について
○ 小畑 孝弘、池田 勝久、松田 幸久(秋田大学バイオサイエンス教育•研究センター 動物実験部門)
(目 的)
近年、国内外の大学および各研究機関間で遺伝子改変マウスの授受が盛んに行われている。しかし、それに伴う弊害がある。
それは施設に病原体が持ち込まれる可能性が増加していることである。そこで、当部門では平成15年からマイクロバリアーケージシステムによるマウス
の検疫を行っている。今回はその過去4年間の検疫成績を紹介する。
(方 法)
検疫システム:使用飼育装置はベントラックシステム(米国アレンタウン社製)、自動給水装置(エデストロム社製)である。
検疫方法:検疫期間を5週間とし、1ケージ当たり4~5匹のマウスを収容した。ケージ交換は1週間に1回安全キャビネット 内で行い、吸水ノズルも同時に交換した。また、囮マウスは(ICR系♂6週齢)3匹を1ケージに収容し、ケージ交換時に検疫用マウスの汚れた床敷少量を混入し、 検疫開始から5週間後にその囮マウスを実中研に検査を依頼した。検査項目はICLASモニタリングセンターのマニュアルに準じた。なお、いずれかが陽性の場合は クリンナップ後SPF区域へ搬入した。また、検査結果の15項目のうち陽性を示した場合はそのマウスを(1)処分をする (2)治療後使用する (3)クリンナップをする。 このうちのいずれかを実験者に選択をしてもらうことにしている。
(成績および考察)
平成15年〜18年現在までの約4年間に国内の大学が23例233匹、研究機関が48例772匹と研究機関からの搬入が多い傾向にあった。 また、国外からの搬入は大学が3例94匹、研究機関は6例69匹であった。そのうち検疫証明書では全てに於いて陰性結果を示していたにもかかわらず、 国内の大学から搬入した23例中4例17%から検疫の結果、Pasteurella Pneumotropica(P.p)2例、Pinworm(P.w)とIntestinal Protozoa(I.p )各1例が 陽性であった。そこで当部門では実験者と相談の結果、P.pの1例は処分、1例は外部施設へのクリンナップを依頼し再度検疫し陰性であることを確認後、 SPF区域へ搬入した。また、P.wは感染実験飼育室に搬入しイベルメクチンで治療し、完全治癒後に実験に使用した。I.p1例は当部門でクリンナップ後、 SPF区域へ搬入した。最近まで当部門では、タコニック社からのマウスは検疫を通さず直接SPF区域に搬入していたがそのグループの中からP.p陽性例が見つかった ことから同社マウスの汚染も否定できない。これらのことから検疫証明書は必ずしも信頼できるものではなく、今後の対応策としては国内のブリーダー以外のマウス については検疫後SPF搬入を考えるべきである
一般講演5
ラットによる無麻酔下頚静脈採血の試み
○葛西律子、馬場秀明、今井信子、工藤 均、八木澤 誠(弘前大学医学部附属動物実験施設)
ラットの部分採血は、尾静脈採血、眼窩静脈採血、外側足根静脈採血法などが知られている。一般的に全採血と言われている
頚静脈からの採血は、採血量も多く、採取量も調節しやすいので、手技を身につければ手軽な採血法と思われる。それをさらに手軽に簡単に採血するために
無麻酔による手保定での採血手技を試みたので報告する。
女性の手は男性の手に比べれば小さく、保定出来るラットの大きさにも限度があると思われる。しかし、近年女性の実験者や
動物実験技術者も増えたこと、また今後義務づけられると予想される教育訓練の実施等に合わせ、実験初心者に指導する意味でも、現場の自分達が手保定
による無麻酔下頚静脈採血の手技を習得したのでこれを紹介する。
合わせて実験途中ではあるが、麻酔薬投与採血と、無麻酔下採血の血球値の違いも比較したので報告したい。
【無麻酔で頚静脈から採血する手技のポイント】
- 解剖して頚静脈の走っている位置をしっかりと把握する。
- 最初はラットを麻酔下で保定板に固定して頚静脈から確実に採血できるように何度も練習する。このとき首の辺りを剪毛すると皮下の静脈走行部位が
かすかに分かり採血しやすい。
- 次にラットの手保定を練習する。最初は5週齢位のラットからはじめ徐々に週齢を上げていき250グラム近くまで保定できるように練習する。
- ラットの保定が慣れてきたら次に採血を試みる。また小さめのラットから始めて徐々にグラム数を上げていく。
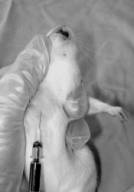
保定 | |

無麻酔での採血 |
|
一般講演6
ウサギにおける安定した非観血式血圧測定法の検討
○福田直樹1)、伊藤恒賢1)、大和田一雄1),2)
(1)山形大学医学部附属動物実験施設、
2) (独) 産業技術総合研究所)
【背景・目的】食後高血症(PHT)家兎はメタボリックシンドロームの病態モデルとして、山形大学医学部附属動物実験施設において作出された。
症状としては、高インスリン血症、内臓脂肪の蓄積、高脂血症等を呈する。しかし、メタボリックシンドロームの診断基準の一つである血圧に関しては、
あまり検討されていない。そこで、私たちは無麻酔非観血式血圧測定によるPHTの血圧測定時の至適条件を検討することとした。
さらに同一個体において給餌前と給餌後の血圧を比較し、食餌による血圧の影響を比較検討した。
【材料・方法】測定には、雄PHT群(2〜5年齢)、雄JW群(2〜3年齢)各5匹ずつウサギの右前肢の毛をバリカンで刈り、 そこに新生児/乳児用ディスポカフ(Colin社製)を
巻き、Kuwaharaらの方法を参考にしウサギを非麻酔下で固定した。箱型固定器は独自に加工したもの を用い、収縮期血圧(SBP、平均血圧(MBP)、拡張期血圧(DBP)、
心拍数(HR)を非観血式自動血圧測定装置(BP-98E)(ソフトロン、東京)を用いて測定した。 脈圧は(SBP- DBP)により求めた。測定はウサギを保定器に設置した時間を
0分とし、以後1分ごとに9〜10分間連続測定を行った。 測定は食餌開始3時間前から食餌開始直前を「食前」とし、食餌開始後2〜5時間内を「食後」として比較検討した。
【結果】測定方法:ウサギを固定器へ設置した後は、心拍数、血圧ともにゆるやかに下降し、設置後10分以内にほとんどのウサギが安定した血圧値を示した。
数例の動物において測定途中に心拍、血圧が上昇する個体が観察されたが、それは測定途中に動くためと考えられた。今回用いた固定器は以前検討したは犬の保定器を
より、ウサギの呼吸等によるノイズデータを拾いにくく、データが安定していた。統計処理:9〜10ポイントのうち心拍数の低い3点の平均値をデータ として用いた。
今回の方法で測定したPHTおよびJWの食後・食後の各測定項目の平均と標準偏差を以下の表に示した。
|
|
食前JW
|
食前PHT
|
食後JW
|
食後PHT
|
|
HR(bpm)
|
186±25
|
240±19
|
214±21
|
251±24
|
|
SBP(mmHg)
|
112±5
|
121±5
|
116±13
|
129±14
|
|
MBP(mmHg)
|
85±13
|
93±8
|
88±14
|
99±13
|
|
DBP(mmHg)
|
73±15
|
79±11
|
75±16
|
83±12
|
|
脈圧(mmHg)
|
39±5
|
42±11
|
41±10
|
46±5
|
PHTとJWのHR、SBP、MBP、DBP、及び脈圧を測定した結果、全ての項目においてPHTが高値を示した。次にPHT及びJWの食前と食後を比較した結果、
PHT及びJWともに食後に高値を示した。
【考察】今回の結果からこの測定方法を用いて設置後10分以内で安定した値を採取することができた。しかしこの方法では食餌に伴う各項目の詳細な経時変化
の測定が難しいため、今後はテレメトリー等の方法を用いた血圧測定が必要であると思われた。
一般講演 7
マウス体外受精における精子の前培養時間短縮に関する検討
○伊藤恒賢1),秦正充1),2),白井優子1),2),菊地淑恵1),2),大和田一雄1),
3)
(1)山形大・医・動物実験施設,2)(株)ジェー・エー・シー,3)(独)産業技術総合研究所)
【背景・目的】山形大学では,平成17年4月より実験動物受託機関の職員を対象として,マウス胚操作(体外受精,胚の凍結,胚の生体内移植等)とそれに
関連するマウス・ラットの繁殖生理学的飼育管理方法に関する研修を行っている。本学で研修した受託機関職員は,現在は関東の大学及び研究所にてマウスの
胚操作業務を主に第1線で活躍している。研修は約3ヵ月であるが,研修内容とは別に,研修期間中に体験した疑問点を,現場の観点から実験調査
する事としており,現在研修者は,マウス体外受精時における精子の前培養時間について検討している。
マウスの体外受精時における精子の前培養時間は,既に専門書や教科書に記載されており,精子は培養開始1-2時間で受精能を獲得するとされている。
そのため,私たちは精子の前培養時間を1-2時間とし体外受精に用いてきた。しかし,私たちは肉眼的に培養開始1時間目の精子が2時間目の精子よりも
活性等で勝っている事を観察・記録していたために,今回は精子の前培養時間の違いと体外受精率の関連性について検討する事とした。
【材料・方法】採卵に用いた雌動物はC57BL/6系を背景としたKOマウス36匹(8-25週齢)であり,体重及び週齢が均等になるように4群(各9匹)に分け,
PMSG(5IU)とhCG(5IU)を定法に従って投与し過剰排卵させた。採卵は,各群の雌動物の淘汰から体外受精までの時間を均一にする目的で,全ての雌動物は体外受精の
15分前に安楽死させ,卵管を摘出した。さらに,採卵時の技術的要素を排除する目的で,4群(各9匹)について1群に付き3名の技術者が3
匹ずつの卵管を摘出し,計9匹分の卵管から2名の技術者がそれぞれ4及び5匹分を卵管膨大部より採卵し,HTF(Human Tubal
Fluid)メディウム内に導入した。
体外受精に用いた精子は,同系統のKOマウス雄2匹(25週齢)の左片側精巣上体尾部より採取し,HTFメディウムにて培養した。精子培養開始後
30(A群),45(B群),60(C群)及び75分(D群)の精子(680精子/μl)をあらかじめ採取していた卵子を含むHTFメディウム内に導入し(6μl),体外受精(
40,800精子/206μl)した。培養20-24時間後に2細胞期胚,1細胞期胚,分葉卵及び死滅卵に分類し,体外受精率(2細胞期胚/2+1細胞期胚)等を比較検討した。
【結果】各群において得られた2細胞期胚の数は,A群(115個),B群(86個),C群(109個)及びD群(82個)と差異を認めず,体外受精率(2細胞期胚数/
2+1細胞期胚)についてもA群(71.0%),B群(70.5%)C群(80.7%)及びD群(71.3%)に統計的有意差を認めなかった。その他の項目についても精子の
培養時間の違いによる差異を認めなかった。
【考察】今回の結果は,1系統のみの検討であるため,他系統への応用が可能か否か等のさらなる検討が必要である。しかし,精子の前培養時間が30
分でも良好であるならば,飼育管理業務と胚操作業務を同一職員が行っている当施設にとって,両者の効率的な運用が可能となる。
一般講演8
マウスのオープン型クリーンラック飼育におけるケージ落下防止ガイドについて
○井上吉浩1)、石橋 崇1)、佐々木秀一1)、高橋智裕2)、中川西 和茂3)
(1)東北大・加齢研・動物施設、2)日本クレア(株)、3)(株)日東エアテック)
当研究所は、「難治性癌」や「痴呆を伴う脳神経疾患」について、加齢の遺伝的プログラムの解明を中心とする基礎研究と、
その先端的な診断及び治療の研究を行っている。このような研究背景の中、当動物施設ではトランスジェニックマウスやノックアウトマウス等の遺伝子組換え
マウスが飼育動物の圧倒的多数を占めており、現在でもこれらのマウスは増加の一途を辿っている。これらのマウスは、カルタヘナ法(二種省令)に従い拡散
防止措置(逃亡防止)において厳格に管理されなければならない。
当施設におけるマウスの飼育は全てクリーンラックを使用しているが、限りある飼育スペースを有効に活用するために、飼育ケージは
日本クレア製のマウスSケージを主体に、給水方式はボトル給水としている。また、飼育ラックはオープン型(前面開放型)
のクリーンラックを使用している(前面扉付あるいはアクリル引戸タイプのラックは全て扉・引戸を撤去して使用)。これにより、多くのマウスを飼育することが
(多くのケージを収容することが)可能となり、マウス増加への対応に貢献してきたとともに、ラック前面がオープンになることにより飼育管理の作業性も良くなった。
しかしながら、本対応により、ラック各段にケージを前後に2列ないし3列と置くことができ棚板手前間際までケージが置かれるため、
地震発生時におけるケージの落下事故が危惧された。2003年7月26日宮城県北部(鳴瀬町、矢本町、河南町周辺)を震源として連続的に発生した地震(最大震度6弱)
では、当地仙台は震度4強であったが、幸いにもケージの落下はなかった(ラック数台が20cm程動いた)。近い将来、「宮城県沖地震」規模の大型の地震が起こるとの予知もあり、
地震の縦揺れ・横揺れの大きさやパターンによってはケージが落下する可能性も予想される。
そこで今回、不測の事態に対応するために、ケージ落下防止ガイドを考案・試作した。本装置はステンレス製のガイドの上げ下げができるよう
に工夫しており、ケージ交換時はガイドをラック棚面と平行になるよう下げて作業を行い、それ以外の時にはガイドを棚面より3cm程度上げてケージの落下を防止する。
この場合にもマウスの点検やケージの出し入れは不具合なく行える。また、ガイド自体は4kgと軽量で上げ下げも容易に行える。使用を開始してから実際に地震が起きて
いないので、その効果を評価するには至っていないが、オープン型の飼育ラックにおけるケージ落下防止ガイドとして、簡易で作業性にも優れ、有効なケージ落下防止装置
であると考えられる。
一般講演 9
山形大学における実験動物飼育管理経費の新しい徴収システム
○ 長橋 武1)、伊藤 恒賢1)、尾崎順子1)、本間 貞明1)、鈴木 浩美1)、
神村 栄吉1)、大和田 一雄1)、2)
(1)山形大学医学部附属動物実験施設、2) (独) 産業技術総合研究所)
当施設ではこれまで、講座からの実験動物飼育管理経費のうち、大学運営資金以外の予算費目については、飼料や床敷、
消耗品等の物品による振替で行ってきた。しかし、物品による振替作業は煩雑であり、伝票の仕分け作業に多くの時間を要した。さらに講座からも、
飼育管理経費の直接振替を希望したい旨の要望があったため、医学部事務と改善に向けて検討を重ねてきた。その結果、平成18年度より、実験動物飼育管理経費の支払いを、
各講座から当施設に直接経費で振替するシステムに変更する事とした。今回は、山形大学における実験動物飼育管理経費の新しい徴収システムを紹介する事とし、以下に、
内容の概略を示す。
- 月毎の飼育匹数集計及び、飼育管理経費算出は従来と同様に、各飼育担当者が講座及び動物種毎に、匹数、単価、日数を乗じて算出している。
- 各飼育担当者が1ヶ月毎に算出した飼育管理経費を、施設事務担当者が3ヵ月分にまとめて、
請求する事とした。従って、講座への請求�・振替手続きは年4回行う事となる。
- 動物の発注については現行通り施設で行うが、大学運営資金による動物購入代の施設立替をとりやめ、講座が動物納品伝票を直接、物品請求システムに発生源入力する事とした。
- 講座への飼育管理経費の通知は、所定の「飼育管理経費等の振替明細」と「飼育管理経費支払い依頼書」により行い、講座では「飼育管理経費支払い依頼書」に記載した金額を確認し、希望する予算費目を記入後、当施設へ提出する事とした。併せて、提出の際に、振替額を物品請求システムに入力し、控えを添えて提出する事とした。
- 施設は、講座から提出された「飼育管理経費支払い依頼書」及び控えを医学部事務に提出し、振替手続きを依頼する事とした。
- 振替手続き後に、医学部事務は講座及び当施設に振替、支払い済みの通知を行い、全ての手続きが完了する。
- 学内資金(大学運営資金、奨学寄附金、受託研究費、共同研究費、受託事業費)については、講座間の振替が適用されるが、学外資金(科学研究費、COE等)は、大学に一旦支払われ、その後、受託事業費として施設へ再配分される。
今後、年度繰越不可能な予算費目は、予算消化の期限が設けられており、予算執行の効率的な運用をするためには、医学部事務との連携が必要である。







