日本実験動物技術者協会
平成19年度 奥羽・東北支部合同勉強会
プ ロ グ ラ ム
日 時:平成19年11月17日(土)9:00〜14:35
場 所:東北大学医学部 第一講義室
共 催:東北動物実験研究会
□ 8:30〜8:50 受 付
□ 8:55〜9:00 開会挨拶 井上 吉浩(東北支部長)
◎ メーカーカレントトピックス
司会:井上 吉浩(東北大・加齢研・実験動物管理室)
伊藤 恒賢(山形大・医・動物実験施設)
(講演20分/質疑5分)
□ 9:00〜9:25
M1. 凍結受精卵からの個体作出(SPF)による本格的な「マウス生産システム」のご紹介
小川 博正(日本クレア(株)・技術部受託業務課)
□ 9:25〜9:50
M2. バイオ関連業務の紹介
大杉 直弘(日本エスエルシー(株) バイオテクニカルセンター)
□ 9:50〜10:15
M3. 次世代遺伝子発現プロファイリング解析法(HiCEP)およびDNA免疫技術を用いた
バイオマーカー探索における研究支援サービスの紹介
子川 雄司(オリエンタル酵母工業(株) バイオサイエンス部)
□ 10:15〜10:40
M4. 北山ラベスにおける生産動物の紹介
守屋 幸治(オリエンタル酵母工業(株) ライフサイエンス部)
□ 10:40〜10:50 休憩
◎ 一般講演(講演8分/討論2分)
□ 10:50〜11:20 座長 神村 栄吉(山形大・医・動物実験施設)
1. ラットにおける不定期照明の妊娠期、出産匹数、体重変動について
○馬場 秀明、今井 信子、葛西 律子、工藤 均、八木澤 誠
(弘前大・院・医・動物実験施設)
2. ラットの血液生化学値の測定機種による差異
○遊佐 寿恵1)、片平 清昭1)、金澤 優子2)、杉原 充3)
(福島県立医大・実験動物研究施設1)、富士フィルムメディカル(株)2)、富士フィルム(株)3))
3. LEAラットとLEA.LEC-Atp7bコンジェニックラットの行動学的特性
○森川 正喜、末田 輝子、岡野 伸哉、笠井 憲雪
(東北大・院・医・動物実験施設)
□ 11:20〜11:40 座長 末田 輝子(東北大・院・医・動物実験施設)
4. 再興感染症にも注目しよう!
○葛西 律子、今井 信子、馬場 秀明、工藤 均、八木澤 誠
(弘前大・院・医・動物実験施設)
5. ラットの盲腸蟯虫駆除の試み -イベルメクチン皮下投与の効果-
○尾崎 順子1)、鈴木 菜絵子2)、伊藤 恒賢1)、大和田 一雄1),3)
(山形大・医・動物実験施設1)、山形大学医学科2)、(独)産業技術総合研究所3))
□ 11:40〜12:50 休憩(昼食)
□ 13:00〜13:30 座長 遊佐 寿恵(福島県立医大・実験動物研究施設)
6. 偽妊娠マウスの効率的な作製および胚移植トレーニングについて
○鈴木 宏子、石橋 崇、高梨 千代、佐々木 秀一、井上 吉浩
(東北大・加齢研・実験動物管理室)
7. 東北大学大学院医学系研究科附属動物実験施設におけるマウス胚操作技術業務
○西尾 啓輔、大竹 誠一、笠井 憲雪
(東北大・院・医・動物実験施設)
8. 山形大学における疾患モデルウサギ精子の凍結保存に関する基礎的検討
-精子の採取、凍結保存及び人工授精の方法について-
○伊藤 恒賢1)、安達 優真2)、秦 正充1),3)、大和田 一雄1),4)
(山形大・医・動物施設1)、山形大・医2)、(株)ジェーエーシー3)、(独)産業技術総合研究所4))
□ 13:30〜14:00 座長 一戸 一晃(環境科学技術研究所)
9. マウスにおける腹腔内および尾静脈内投与技術の習得経験
○石橋 崇、井上 吉浩
(東北大・加齢研・実験動物管理室)
10. マウスの飼育ケージに木材片を入れてみる
○丹治 静保、遊佐 寿恵、片平 清昭
(福島県立医大・実験動物研究施設)
11. マウスの妊娠から出産、離乳までにおける簡易な暗夜飼育が繁殖成績向上に寄与する
石橋 崇、鈴木 宏子、佐々木 秀一、高梨 千代、高橋 豊和、○井上 吉浩
(東北大・加齢研・実験動物管理室)
□ 14:00〜14:30 座長 馬場 秀明(弘前大・院・医・動物実験施設)
12. 基本外科手技習得実習におけるクリニカルパスの作成
○高橋 智輝1)、牛崎 克哉1)、佐藤 綾子1)、高橋 恵理1)、川村 祐介2)、遠山 稿二郎1)
(岩手医科大・動物実験センター1)、岩手大学2))
13. 東北大における改良型ウサギケージの紹介
○白幡 春菜、柏山 浩、末田 輝子、笠井 憲雪
(東北大・院・医・動物実験施設)
14. 東北大学における学内規程運用の紹介と新規定における技官の役割
○末田 輝子、笠井憲雪
(東北大・院・医・動物実験施設)
□ 14:30〜14:35 閉会挨拶 馬場 秀明(奥羽支部長)

メーカーカレントトピックスM1
小川 博正(日本クレア(株)・技術部受託業務課)
遺伝子組換え動物(マウス・ラット)が広く用いられるようになり、いずこの飼育室でも、TgマウスやKOマウスの収容スペースの確保に悩まされています。 これを解消するため、通常使用しないマウス系統は、凍結受精卵を確保して、コロニーを閉鎖、必要な時に、融解・移植により個体を作出して来たものと思います。 しかしながら、これまで、その作出規模は、比較的小さく、多くは100匹程度であったものと思います。最近、ますます遺伝子組換え動物(マウス・ラット)が増えており、 もっと、本格的な「生産システム」が必要と考え、弊社では、2006年2月に稼動しました「富士宮技術サービスセンター」において、BS(バリアシステム)施設内に凍結受精卵からの 個体作出(SPF)業務を、ルーティーンに、大規模に、そして、なにより「安全に」実施するためのシステムを構築致しました。
現状、当該施設 1週間での融解・移植規模は『凍結受精卵1,000個』、個体発生率は、系統等により違いますが、おおよそ400匹前後のマウスを作出、 これを毎週連続して実施することが出来ます。この規模は、現在拡大中で、近日、1週間で『凍結受精卵 2,000個の移植 ⇒ 800匹前後』の作出が可能になります。
当該施設は、「1)レシビエントマウスの作出用エリア」と「2)凍結受精卵の融解・移植用のエリア」、さらに「3)移植後のレシピエントマウスが出産・哺育・離乳し、 微生物検査終了まで育成するエリア」の3つのエリアから成り立ち、万一『凍結受精卵の融解・移植』に起因する汚染が起きた場合でも、その拡大を最小限に留めることが出来る様、 それぞれのエリアの構造・使用方法等を工夫致しました。今回は、この点を中心に紹介させて戴きます
メーカーカレントトピックス M2
大杉 直弘(日本エスエルシー(株)バイオテクニカルセンター)
遺伝子操作マウスの開発が引き金になり各研究施設におけるマウスの使用数は増加の一途をたどり、動物の飼育スペースおよび確かな技術を持った飼育技術者の確保が、 動物実験・研究をスムーズに実施する上での極めて重要なポイントになっている。そのような状況において、10年以上前から実験動物ブリーダーを中心として、各研究者の実験サポートを目的 としてマウスを含む各種実験動物の受託飼育サービスが開始された。信頼性のある動物実験データを得るためには、遺伝学的、微生物学的な知識・技術に裏うちされた実験動物飼育・繁殖の技術・ ノウハウを持った技術者および適切な施設を欠くことはできないが、そのような技術者・施設を擁する実験動物ブリーダーはまさにその適任といえる。また、遺伝子操作マウス・各種疾患モデル マウスが国境を越えて研究者間で行き来するようになり、それらの微生物学的な管理技術・クリーニング技術、さらには凍結胚・精子の作製・蘇生技術も欠くことのできないものになり、 そのような技術の蓄積を豊富に有する実験動物ブリーダーが当該技術の提供を受託サービスとして実施することは必然的である。
ライフサイエンス研究者をサポートする実験動物ブリーダーとしての日本エスエルシーにおけるマウス・ラット(遺伝子操作、疾患モデル)の受託生産および その周辺業務について以下の項目を中心に説明する。
- 受託生産(自然交配・生殖工学的手法によるもの)
- 微生物学的クリーニング(子宮切断術・生殖工学的手法)
- 受精卵(胚)・精子の採取・凍結および保管ならびに蘇生
- ICSI(顕微授精)を利用した個体蘇生
- 系統化、戻し交配、ゲノムタイピング(PCR)
- 遺伝子操作マウスの作出
- 凍結卵(胚)の作製・供給
- 各種器官の採取・供給
メーカーカレントトピックス M3
子川 雄司(オリエンタル酵母工業(株) バイオサイエンス部)
近年、DNAマイクロアレイをはじめとする遺伝子発現プロファイル解析技術の進歩により、様々な生物の遺伝子機能を体系的・網羅的に解析することが可能となってきた。 遺伝子発現プロファイル解析技術は、癌をはじめとする多因子性疾患の発生・進展プロセスの解明や、新たな診断法の開発、治療法の改善などへも応用されつつある。 一方、蛋白質の機能解析やバイオマーカーの探索、治療用抗体の開発などにおいて、ネイティブフォームの蛋白質を認識する抗体の開発が必要不可欠であり、多種多様な蛋白質に対して、 短期間で有用な抗体を作製する技術が求められている。
当社は、遺伝子発現プロファイル解析技術として独立行政法人放射線医学総合研究所・遺伝子発現ネットワーク解析グループの安倍真澄博士らが開発した HiCEP技術を導入し、自社製品の開発や受託解析を行っている。また抗体作製においてはGenomic Antibody TechnologyTMと呼ばれるDNA免疫抗体作製技術を持つ米国最大の 抗体作製企業Strategic diagnostic Inc.と業務提携し、DNA免疫による抗体作製サービスを提供している。
本研究会では、HiCEPの原理とその有用性並びにDNA免疫による抗体作製サービスの概要を紹介する。
(HiCEP技術とは)
HiCEPとは、配列情報の有無に関わらず試料間で転写発現レベルに差のある遺伝子を網羅的に比較検討・抽出し、必要に応じて該当する遺伝子の配列を同定することが できるツールである。AFLP法が基盤となっており、1)poly(A) RNAのcDNAへの逆転写、2)制限酵素切断、?アダプター配列付加、3)DNA増幅、4)D高解像度電気泳動、5)サンプル間の泳動パターン比較、 という工程からなる。HiCEPの特徴は、DNAマイクロアレイ法と比べて高感度かつ再現性の高い発現解析が可能なことであり、1回の解析で1万から3万種類の転写産物を検出し、かつ1.5倍差以上の 発現変動差を示す転写産物を識別することができる。またHiCEPで測定される遺伝子の発現変化率は、定量PCR法と80%以上の相関性を持つということも分かっている。
(Genomic Antibody TechnologyTMとは)
Genomic Antibody TechnologyTMは米国Strategic Diagnostics Inc. によって開発されたDNA免疫を用いた抗体作製技術であり、デジタル情報を抗体 にする新しいテクノロジーである。目的となる抗原の塩基配列/アミノ酸配列から独自のアルゴリズムによって最適領域をデザインし、その領域を組み込んだ発現ベクターを直接マウスやウサギに 免疫することによって、目的抗原に対する抗体を得ることができる。本技術により、抗原を調製するという従来の工程と期間が不要となる。
メーカーカレントトピックス M4
守屋 幸治(オリエンタル酵母工業(株) ライフサイエンス部)
北山ラベス株式会社において、生産・供給されている実験用動物(ウサギ・イヌ)を紹介する。
また、平成17年6月に動物の愛護及び管理に関する法律の一部を改正する法律が公布され、動物実験に関する理念である動物福祉の3Rが盛り込まれた。
これらの動きを鑑み、当社においても動物福祉に対してブリーダーの立場でできることを常に模索しつづけているが、その取組みの一端を紹介する。
一般講演1
○馬場 秀明、今井 信子、葛西 律子、工藤 均、八木澤 誠
(弘前大学大学院医学研究科附属動物実験施設)
私どもは、これまでラットを用いた実験により、生理的リズムが照明環境と密接に関係し変化することについて重ねて報告してきた。
そこで、不定期照明にした場合、ラットの妊娠期、出産匹数、体重等に変動が見られるか十分に把握しておく必要があると考えた。
以下の方法で検討したので報告する。
【方法】
市販のラットSD ♂8週令 3匹、♀ 7週令 9匹を使用
各群の飼育室の照明設定
- 各群♀の性周期確認
- 発情前期を確認後♂を同居させる
- 翌日スメアを採取し、交配の有無を確認
- 出産日まで待つ
- 各群の出産匹数を確認
- 各群4週令で離乳、うち♂3匹使用する
- 各群の体重測定を4週令〜6週令まで、1週間置きに測定する
- 各群の体重平均値の比較
一般講演2
○遊佐 寿恵1)、片平 清昭1)、金澤 優子2)、杉原 充3) (福島県立医科大学実験動物研究施設1)、富士フィルムメディカル(株)2)、富士フィルム(株)3))
[目的]
実験動物領域においても血液生化学測定装置としてドライケミストリー法が多用されている。精度管理のため相関性や、再現性、 正確さが検証されてはいるものの、多くはヒトの標準血清を使用して行っているのみである。本来ならば全ての測定項目に対して、動物種ごとに確認しなければならない。 我々は、従来からラットにおける血液生化学検査精度向上を目指してさまざまな基礎的実験や工夫を試みてきた。今回、ラットの生化学値について同一検体を複数の機種 で測定しその差異について比較検討した。
[材料及び方法]
- 供試動物:Jcl:Wistar 9〜10週齢、メス11匹、オス10匹
- 飼育条件:SPF飼育、飼料:固形飼料(CE-2、日本クレア製)不断給餌、水:水道水を自由摂水
- 測定機器:3機種を用い、2機種のフジドライケムの場合は同一ロットの測定スライドを使用した。A:自動分析装置(日立7180)、B
:フジドライケム(FDC7000、富士フィルムメディカル製)、C:フジドライケム(FDC3500s、富士フィルムメディカル製
- 検査項目と検体:TCHO(総コレステロール)、TG(トリグリセライド)、BUN(尿素窒素)は血清、GLU(グルコース)、GOT
、GPTについては血漿を使用した。さらに血漿については残存する血小板のGOT、GPTの影響を除くために測定前に再度遠心分離した。
- 採血・測定:1) 採血前日夕刻から絶食 2) 翌日9:30〜11:00にペントバルビタール(Dainabot製,NembutalⓇ) 腹腔内麻酔(50mg/kg体重)下で開腹し、腹部大静脈から抗凝固剤としてヘパリンナトリウム30単位入りのシリンジで約2.5mlを採血し血漿用試料、再度プレーンな シリンジで約2.5ml採血し血清用とした。 3) 血漿用試料は直ちに3000rpm(1,670G)10分間の遠心分離し上清を新たな試験管に分注した。血清用は1 〜1.5時間後に遠心分離した。 4) 採血当日にフジドライケムFDC3500sにて6項目を測定 5) 翌日フジドライケム7000と日立7180の2機種でTCHO、 TG、BUNを測定 6) また、血漿をクライオチュ-ブに分注し-80℃で保存した。10日後にフジドライケム7000と日立7180を用いて
GLU、GOT、GPTの3項目を測定した。
- 統計学的検討はDr. SPSS IIのStudent's t-testを用い、三群の比較には一元分散分析を用いた。
全ての測定値は相関が高かった。GPTについてはFDC7000と日立7180ではr=0.903、またFDC3500と日立7180では r=0.911とやや相関が低かったが、その他の項目はr=0.95以上であり、特にFDC3500sとFDC7000ではr=0.99と高い相関性が認められた。しかし、 測定機種間の平均値を比較すると、TCHOの場合は日立7180とFDC3500s、GOTとGPTの場合が日立7180とFDC3500s、FDC7000に有意差があった。br>
[まとめ]
フジドライケムFDC3500sとFDC7000を用いたラットの血液生化学測定(TCHO、TG、BUN、GLU、GOT、GPT)は自動分析装置の汎用機種 である日立7000と相関が高く、信頼しうる測定値と思われる。ただし、平均値で比較すると機種間で有意差が認められる項目もあるので、機種による偏向傾向を確認して おくことが重要である。生化学値測定の検査精度向上のためには動物種ごとの標準血清・血漿が必要と思われるが、まだ供給されていない現状である。正常動物や疾患モデル 動物の標準血清・血漿を作製すべきと考える。
一般講演2
○森川 正喜、末田 輝子、岡野 伸哉、笠井 憲雪
(東北大学大学院医学系研究科附属動物実験施設)
幼若期のラットは活発で、我々飼養者がそのケージを交換する際、ほかの時期の動物に比べ注意を必要とする。当施設で飼育されているLEA ラット(以下LEA)と、ウィルソン病モデル動物(LECラット)の原因遺伝子である変異Atp7b遺伝子をLEA/Sendaiコンジェニックラット(以下LEA.LEC-Atp7b )はその特徴が顕著で、他系統の動物よりもケージ内をよく動き回り、その動きも鋭敏であることが観てとれる。また、小さな衝撃にも敏感に反応するため、ケージを交換するにあたり細心の注意を必要としている。そこで、観察の結果から他の系統と異なる活動性を有すると考えられるLEA、 LEA.LEC-Atp7bをコントロール系統として用いたLEラット(以下LE)と共に行動評価を行い、LEAとLEA.LEC-Atp7bにおける行動学的特性を比較することを目的とした。
(動物と方法)
- 5週齢から単飼育したLEA (9匹:♂)、LEA.LEC-Atp7b(7匹:♂)、LE(8匹:♂)に試験を実施し行動評価を試みた。
- 通常の飼育環境における一般行動の活動性を評価するため、自発運動量の測定を6〜7週齢の期間に行った。
- 動物が新奇環境に曝された場合の活動性を評価するため、オープンフィールド試験を6週齢時に実施した。
- 情報処理障害を指標とした行動評価をするために、7週齢時にプレパルス インヒビションを調べた。
(結 果)
自発運動量を測定した結果、LEA 、LEA.LEC-Atp7bともにLEと比べると、運動量が有意に高いことから、一般行動における活動性はLEA、LEA.LEC-Atp7bが高いと考えられる。一方で、オープンフィールド試験の結果から、新奇環境において、LEが他の2系統と比較して有意に高い活動性を示した。
一般行動や新奇環境における活動性はLEAとLEA.LEC-Atp7bの間に差はみられなかった。しかし、プレパルス インヒビションの解析の結果、LEA.LEC-Atp7bがLEAよりも、プレパルスの効果が低いことがわかった。このことは、LEA.LEC-Atp7bとLEAにおいて情報処理の機構に違いがある可能性を示唆している。
一般講演 4
再興感染症にも注目しよう!
○葛西 律子、今井 信子、馬場 秀明、工藤 均、八木澤 誠
(弘前大学大学院医学研究科附属動物実験施設)
実験動物を飼育管理する者として重要な課題は、動物を病原微生物の汚染から未然に防ぎ、また感染がみられた場合はその感染症を最小限に抑えることである。最近頻発しているMHVなどウィルス性感染症は非常に重要視され、その傾向や対策などが取りざたされている。しかし従来からあり、そして依然として消え去ることのない蟯虫やダニなど、再興感染症にも目を向ける必要があるのではないだろうか。私どもは昨年から今年にかけて、これらの感染症に感染し、駆除の経験をしたのでその概要について報告する。
当施設では年4回の微生物モニタリングをしている。昨年行った検査で蟯虫の成虫が確認された。今まで全く心配していなかった訳ではなかったが、モニタリングにより現実をはっきりと突きつけられた形となった。蟯虫検査は動物に負担を掛けることなく簡単に出来るので、即施設全体の汚染状態を把握することになった。最初に行ったのは検査時刻など効率的な検査法の検討である。次にマウス、ラット全飼育室の全ラック、格段ごとに最低でも2〜3検体という徹底した検査を行った。マウスはテープ法と浮遊法の併用、ラットはテープ法で検査した。その数合わせて2千枚近くにも及ぶ検査数となった。これで汚染の広がりを正確に把握することができた。が、それからである。現場の問題だけでも検討しなければならないことが山ほどある。検討に検討を重ねた。飼育室は勿論のこと、実験室、実験器具、そしてロッカーに入っている器具にいたるまで、マウス、ラットが直接接触した可能性のあるものは全て滅菌洗浄、あるいは廃棄、と施設職員が一丸となり虫卵の1個たりとも残さない覚悟で駆除に取り組んだ。
また、蟯虫駆除後当施設に某国立大学より遺伝子操作マウスが搬入された。一連の検査でそれらのマウスからも蟯虫が見つかった。蟯虫どころかダニまで見つかった。今更ダニ?教科書にも載っていないとっくに忘れ去られた過去の代物。マウスはコンベである。コンベではあるがきちんとした国立大学からの譲渡である。遺伝子改変マウスが盛んにやり取りされている昨今、病原微生物の侵入する危険性に溢れている。搬入時に慎重に検査する必要性を痛感した。
蟯虫検査は駆除3ヶ月後の今年2月に1回目を行ったがすべて陰性であった。1年後の9月に2度目の検査を行ったが、一部の実験者のマウスに蟯虫の虫卵が見つかった。感染の原因ははっきりしないが種類はほとんどがテープ法では検出できないAspiculuris tetrapteraである。
蟯虫の検査法は一般的にテープ法が紹介されているがそれだけでは不十分である。マウスはテープ法と浮遊法、両方の検査を併用しなければ完全なる蟯虫汚染の把握は難しい。
一般講演 5
ラットの盲腸蟯虫駆除の試み -イベルメクチン皮下投与の効果-
○尾?? 順子1)、鈴木 菜絵子2)、伊藤 恒賢1)、大和田 一雄1),3)
(山形大・医・動物実験施設1)、山形大学医学科2)、(独)産業技術総合研究所3))
【目的】
当施設のラット飼育室では盲腸蟯虫の感染が確認されている。しかし、ラット飼育室は、オープンラックによる飼育形態であるため、ケージ間の感染を防ぐことは難しい。また、長期の実験を行っている利用者も多く、閉鎖して洗浄・滅菌することが出来ない。このような状況で、飼育担当者および利用者が動線を遵守し感染拡大を防いでいる。
これまで、実験動物に対する駆虫法として薬剤による方法が知られているが、駆虫までに時間を要する等の問題があった。そのため、我々は動物用駆虫薬として知られるイベルメクチンを用い、短期間で効果的に駆虫したいと考えた。イベルメクチンは、牛や豚などの家畜に対して投与する場合、皮下投与が一般的である。しかし、実験動物にイベルメクチンを皮下投与した場合の駆虫効果については報告がない。そのため、ラットの盲腸蟯虫に対するイベルメクチン皮下投与法による駆虫効果について検討した。
【材料と方法】
盲腸蟯虫に感染したラット(Slc:SD、5〜6週令)24匹を用いた。イベルメクチン(アイボメック注「メリアル」:日本全薬工業(株))の投与量は1、2、3、4、5、6 mg/kg(牛・豚の3〜30倍)とし、頸背部皮下へ単回投与した。投与後、体重測定およびセロハンテープ法による虫卵の有無を調べ、陽性・陰性を判断した。
【結果】
1 mg/kg群はイベルメクチン投与後も陽性のまま推移した。2および3 mg/kg群では、一度陰性となったがこの期間は短く、投与後12日目には全例陽転した。4〜6 mg/kg群では、投与後2日目より陰性となる個体が現れ、投与後10日目には全ての動物が陰性となり、用量依存的に駆虫効果が高くなる傾向を示した。また、イベルメクチン投与後に検出した虫卵は、投与前に比べ明らかな形態の変化を認めた。なお、投与期間中はラットの外貌や行動に異常を認めず、体重は全群で順調に増加した。
【考察】
ラットのイベルメクチン皮下投与は、牛や豚に比べ10倍以上の用量で駆虫効果が得られた。今回設定したイベルメクチン投与量で、用量依存的に駆虫効果が高い傾向が示されたことから、現在イベルメクチン投与量を増やし、単回皮下投与での駆虫効果についてさらに検討している。また、イベルメクチン投与後に見られた形態が変化した虫卵について、感染性の有無など検討する必要があると思われた。
一般講演 6
偽妊娠マウスの効率的な作製および胚移植トレーニングについて
○鈴木 宏子、石橋 崇、高梨 千代、佐々木 秀一、井上 吉浩
(東北大・加齢研・実験動物管理室)
【目的】マウス胚移植には、精管結紮したオスマウスと交配し膣栓が確認された偽妊娠マウスが用いられ、その卵管あるいは子宮に移植される。発情期のマウスは交尾刺激により偽妊娠状態が成立し、移植した胚が着床・妊娠に至る。当施設では、所内研究者への研究支援業務としてトランスジェニックマウスの作製を行っているが、これに使用されるマウスとして、採卵用マウス(オスとメス)および胚移植用マウス(精管結紮オスとメスマウス)とがあり、作製依頼の需要にもよるが、これらのマウスコロニーストックの規模としてクリーンラック1台を専用に使用している。演者らは、限りある飼育スペースを有効に利用するために、また、ストックマウス管理の省力化を図るために、偽妊娠マウス作製用のマウスは、ランダム交配ではなく、発情の有無を確認し、発情が確認されたマウスのみを選抜して交配を行っている。今回、この選抜交配が有効であることを実験的に確認したので報告する。一方、胚移植技術は、胚操作技術の「つめ」の段階の極めて重要な技術である。移植技術がマスターされていなければ、それまでのマイクロインジェクション作業や胚操作が全て水の泡になる。そこで、演者自身が胚移植技術を習得するまでのトレーニングおよびその成果について併せて紹介する。
【材料と方法】実験には、ICRマウス(日本クレア)を6週齢で購入し使用した。オスマウスは常法により精管結紮を行い8週齢以降で使用した。メスマウスは7週齢から12週齢の間で交配に使用した。交配は夕方4時に行い、翌日朝に膣栓を確認した。胚移植にはC57BL/6マウスの胚を用いた。
【結果】ランダム交配では、メスマウス30匹を交配した内、11匹(37%)に膣栓が確認された。一方、発情期と判定したメスマウスを選抜して交配したものでは20匹の内、18匹(90%)に膣栓が確認され、交配率が有意に上昇した。以上の結果から、選抜交配は極めて効率の良い方法であることが示された。一方、胚移植トレーニングにおいて、採卵した胚は、操作用ピペットで培地-培地間、培地-微小滴培地間、微小滴培地-微小滴培地間の移動練習、および移植用ピペットに胚をセットする練習(18機会、計27時間)を行い、実際に胚の移植(8機会、計10時間)の練習を行った。練習期間中の胚移植の成功率は50% (5匹出産/10匹)であったが、練習4回目の移植から現在まで殆ど失敗することなく妊娠・出産させることができるようになった。
【考察】ICRマウスの発情の鑑定は、近交系マウスに比べて極めて容易であり、確認作業の手間もほとんどかからない。したがって、発情期のマウスを選抜して交配を行うことにより極めて高い交配率が得られ、精管結紮マウスと移植用マウスのストックはランダム交配を行う場合よりも、おおよそ半分程度の規模で十分であると考えられ、有効な方法である。一方、胚移植技術の習得は、得て不得手の個人差も加味されるものの、研究上、貴重な胚(生物資源)を無駄にしないためにも十分なトレーニングを行う必要があると考えられる。
一般講演 7
東北大学大学院医学系研究科附属動物実験施設における
マウス胚操作技術業務
○西尾 啓輔、大竹 誠一、笠井 憲雪
(東北大学大学院医学系研究科附属動物実験施設)
【目的】我々は、研究者の要望に応えるべく平成16年度にマウス胚凍結保存サービスを、翌年度に微生物クリーニング業務と凍結胚融解業務を開始した。そこで、平成18年度から現在までの各々の依頼状況および成績について報告する。
【材料および方法】マウス胚凍結保存方法は、2細胞期胚を簡易ガラス化法で行った。2細胞期胚は、 提供雄マウスに過排卵処理した提供雌マウスもしくは市販雌マウスを使用して体外受精や自然交配で無菌的に採取した。凍結胚の一部を融解して個体発生率検定を行い、 凍結保存胚数200個以上、個体発生率検定30%前後以上の時凍結完了とした。微生物クリーニング方法は、受精卵移植法で行った。受精卵移植法は、2細胞期胚をマウス 胚凍結保存法と同様の方法で採取し偽妊娠マウスに移植した。移植後はアイソレーターで飼育し、離乳後親マウスを依頼者が希望する微生物検査項目で微生物検査に提出した。 微生物検査項目すべてに陰性の場合は微生物クリーニング終了とした。凍結胚融解方法は、凍結胚の融解方法に従い融解し、偽妊娠マウスに移植した。移植後は微生物 クリーニング業務と同様の方法で行った。
【結果】マウス胚凍結保存業務の依頼は、15系統あり、13系統は凍結完了した。凍結胚総数は4,140個、平均個体発生率検定は38%となった。微生物クリーニングの依頼は、13系統あり、11系統は依頼者が希望する微生物検査の14〜16項目においてすべて陰性であった。2細胞期胚総数668個、産仔総数310匹で平均出生率は46.4%であった。凍結胚融解業務の依頼は、2系統あり、2系統とも依頼者が希望する微生物検査の14項目においてすべて陰性であった。凍結胚総数は80個、産仔総数25匹で平均出生率は31.3%であった。この結果からこれらの業務は順調に行われているといえる。
一般講演 8
山形大学における疾患モデルウサギ精子の凍結保存に関する基礎的検討
-精子の採取、凍結保存及び人工授精の方法について-
○伊藤 恒賢1)、安達 優真2)、秦 正充1),3)、大和田 一雄1),4)
(山形大・医・動物施設1)、山形大・医2)、(株)ジェーエーシー3)、(独)産業技術総合研究所4))
【背景と目的】山形大学では遺伝性高コレステロール兼高トリグリセリド血症ウサギ(WHHL-TGH: Watanabe heritable hyperlipidemic Rabbit Triglyceride-high)、遺伝性高コレステロール兼低トリグリセリド血症ウサギ(WHHL-TGL: Watanabe heritable hyperlipidemic Rabbit Triglyceride-low)及び食後高トリグリセリド血症ウサギ(PHT: Postprandial Hypertriglyceridemia Rabbit)と3系統の高脂血症モデルウサギを繁殖継代している。しかし、ウサギはマウス・ラットに比較して大型であるため、維持するには広い飼育スペースを必要とする。また、ウサギの継代においては近交退化が起こらないように充分なコロニーを維持して繁殖する必要がある。さらに当施設で維持している3系統の高脂血症モデルウサギは特性のチェックが必要な事や、繁殖可能な期間が短いために維持管理に高度な技術と多くの労力を必要とする。
このように疾患モデルウサギを生体で維持するためには、飼育スペースの確保、経済的コストがかかる事、並びにマンパワーが必要となる。
そこで私たちはこれらの問題を解決するために、発生工学的手法を用いて精子の凍結と凍結精子を用いた人工授精が3系統の疾患モデルウサギにも応用可能か否かを検討した。
【材料及び方法】動物は7ヵ月齢から2年3ヵ月齢までの日本白色種(JW)及びPHTを用い、精子の凍結は射出精子と精巣上体尾部由来精子の2種類で検討した。射出精子は人工膣を用いた横取り法にて採取し、精巣上体精子は生理食塩水3 mlに精巣上体尾部2個を入れ、数カ所切開しMixerで4分間振動させて得た。また、精子の耐凍剤としてHaradaとNagaseらの方法を参考に卵黄アセトアミド液(egg yolk-acetamide 液:2.25 g glucose, 3.80 g lactose, 5.41 g raffinose, 5.91 g acetamide, 20 ml egg yolk, 80 ml water)を用いた。採取した精子は最終精子濃度25×106精子/0.5 mlになるように耐凍剤で約6倍に希釈して精子希釈液とした。精子希釈液は冷蔵庫で約4時間静置し4 ℃に冷却した後に凍結用の容器に分注した。精子の凍結容器は2種類を検討した。すなわち0.25 mlストローと1 mlクライオチューブを準備し、ストローには0.2 ml、クライオチューブには0.5 mlの精子希釈液を入れた。それぞれの容器に入った精子希釈液は、液体窒素の気相で15分間冷却した後に液体窒素中に投入した。凍結精子の融解は、ストローの場合は37 ℃の温水中に15分間投入し、クライオチューブの場合はドライバスに15分静置して融解精子を得た。2つの方法とも、融解精子の生存率は約20 %と同様であったため、その精子希釈液を4-5ヵ月齢のPHT雌ウサギに人工授精した。
今回の勉強会では、人工膣を用いたウサギ精子の採取法や精子の凍結融解法及び人工授精法について写真を用いて紹介する。
一般講演 9
マウスにおける腹腔内および尾静脈内投与技術の習得経験
○石橋 崇、井上 吉浩
(東北大・加齢研・実験動物管理室)
【目的】マウスの動物実験において、薬液投与や細胞移入を行う場合あるいは注射麻酔を行う場合は、腹腔内投与あるいは尾静脈内投与が多用される。動物の保定と併せて最も基本となる重要な技術である。これらの投与技術を習得するまでには、ある程度の訓練が必要となる。また、動物施設を管理する技術者としても、動物愛護の3Rの観点から実験初心者に対して技術指導を行うケースも増えてきている。今回、これらの投与技術を習得するまでのトレーニング経過と習得のキーポイントを紹介する。
【材料と方法】1) 腹腔内投与;1 mlシリンジと26G×1/2” S.B注射針を用いた。投与液は市販の墨汁を用い、投与量は0.2 mlとした。無麻酔でマウスを片手で保定し投与した。投与後、マウスを開腹し、腹腔内に一様に墨汁が満たされていれば成功とし、皮筋下や腸・膀胱などに誤注射されていれば失敗とした。2) 尾静脈内投与;1 mlシリンジと27G×3/4” S.B注射針を用いた。投与液は生理食塩液を用い、投与量は0.1 mlとした。投与は、無麻酔でマウスを固定用ホルダー(日本クレア製)に装着し、エタノールを浸したキムワイプで尾をマッサージして尾静脈を怒張させ、できるだけ怒張した外側尾静脈を標的とした。また、人道的エンドポイントを考慮し、静脈1本に付き多くても3回までの刺入とし、尾静脈2本に刺入、チャレンジした(最多で6回の刺入)。投与液が抵抗感なく血管を上行するのが確認できれば成功とし、同じマウスにそれ以上の刺入は行わなかった。マウスは、C57BL/6、BDF1、およびNODマウスを用いた。
【結果】腹腔内投与は、実施機会5回、計32匹のマウスにチャレンジした。始めは、大腸や膀胱などへの誤注射があったが、投与機会2回目・7匹目のマウスから確実に投与ができるようになった。最終的に成功率は94 % (30/32)であった。一方、尾静脈内投与は、実施機会9回、計70匹のマウスにチャレンジした。当初、血管刺入の微妙な角度や刺入の深さ、針の進め方などの感覚がなかなかつかめず失敗を繰り返したが、投与機会を重ねるごとに成功の感覚がつかめてきた。しかしながら、練習後半の成功率は59 % (17/29)と成功する確率が高くなったものの、全体での成功率は49%(34/70)であった。以上の結果から、腹腔内投与は高確率で成功させることができる技術であるのに対し、尾静脈投与は練習を重ねても成功率の向上が難しい技術であることを実感した。
【考察】マウスの腹腔内投与および尾静脈内投与技術は、実験動物技術者としても必須の技術であるが、特に、尾静脈内投与技術は確実に成功するためには相当の訓練と集中力を要すると考えられる。今後、習得したこれらの技術を実験初心者への技術指導に役立てていきたいと考える。
一般講演 10
マウスの飼育ケージに木材片を入れてみる
◯丹治 静保、遊佐 寿恵、片平 清昭
(福島県立医科大学・実験動物研究施設)
目 的:
最近、実験動物施設ではノックアウトマウスを始め、遺伝子組み換え動物が急増している。遺伝子に何らかの操作を加えたマウスは交配や繁殖に困難を伴いその上、離乳後の育成過程においても野生種よりも弱い。当施設では研究資源として貴重なマウスを飼育するにあたり水漏れ事故等のリスク回避のために給水方式を自動給水から給水瓶に変更した。
100ml用給水瓶であっても幼若齢マウスで水漏れによる衰弱死亡等を経験する場合がある。そこで、水濡れの際の待避場所の確保を図る目的で、木片の利用を試みた。木片はマウスの環境エンリチメントの効果も期待できた。
方 法:
供試動物はC57BL/6Jオス若齢(3〜7週齢)10匹、高齢(19〜23週齢)14匹とした。若齢、高齢をそれぞれ2群に分け一方には約15cm × 8cm(厚さ1cm)の大きさの杉材の木片を2枚入れ(木片群)、何も入れないケージ(非木片群)と比較した。飼育ケージにはプラスチックケージ(岡崎産業株式会社製、M-7)を用い、滅菌済の床敷(株式会社イワクラ製、“とこじき”)を約100 g分注した。給水瓶はツイスト式給水瓶(日本クレア製、CK-100S、CK-200S)を使用した。こぼす水の量はそれぞれの給水瓶の口一杯量が水漏れしたことを想定し、160mlと240mlとした。実験1.ケージ交換直後に160ml、または240mlの水をこぼした。実験2.ケージ交換後7日間飼育後に160ml、または240mlの水をこぼした。水をこぼす前と床敷を濡らしてから24時間後におけるマウスの体重を測定し、前後の測定値の差を求めた。飼育室は、室温22〜24℃、湿度50〜60%、照明は7:00点灯、19:00消灯の12時間照明の飼育環境である。
結 果:
若齢の場合、全ての条件下で木片群の水漏れ後の体重が非木片群より低い値であった。特に、ケージ交換直後の160mlの水漏れの場合とケージ交換7日後の240mlの場合は木片群と非木片群間に有意差があった。また、高齢マウスは若齢マウスとは異なりケージ交換直後の場合は体重差が明瞭でないが、7日間飼育後の汚れケージの場合は体重減少傾向が明瞭であった。
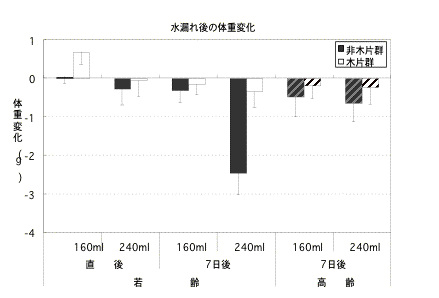
まとめ:
木片は水分の吸収性、保温性があるので水漏れ事故の際はマウスの待避場所となり、体重の減少が少ないものと考えられた。汚れケージの水漏れの場合には、マウスの体毛は糞尿の混濁水で汚れ体温が低下しやすいので、特に遺伝子組み換え動物にとってはリスク回避効果が大きいと思われた。木片は床敷と同様の素材であるので、マウスが囓っても安全である。また、入手が容易であり、洗浄滅菌し再利用可能でもある。木片を持ち上げて移動させたりするマウスの遊び行動もみられ、環境エンリチメント効果が期待できる。
一般講演 11
マウスの妊娠から出産、離乳までにおける簡易な暗夜飼育が
繁殖成績向上に寄与する
石橋 崇、鈴木 宏子、佐々木 秀一、高梨 千代、高橋 豊和、○井上 吉浩
(東北大・加齢研・実験動物管理室)
【目的】遺伝子組換えマウスや疾患モデルマウスは、その遺伝背景等により、免疫機能、生理的機能あるいは代謝機能が障害を受けている場合も多く、そのため繁殖能力が低い系統や出産直後の保育放棄による食殺などのリスクが伴うケースが認められる。自然交配による系統維持ができない系統については、体外受精などの生殖工学技術や里親哺育を実施する方法などが解決手段として用いられるが、軽度に繁殖能力が低下しているマウスの系統維持は、熟練した日常の繁殖管理で解決できる場合もある。また、日常の過度の干渉が繁殖成績を低下させている可能性も示唆される。そこで演者らは、マウスが妊娠してから、出産、離乳までの期間において、できるだけ母獣マウスを刺激・干渉しない簡易な暗夜飼育を行うことによりマウスの繁殖成績に寄与するかどうかを検討した。
【材料と方法】実験には、遺伝子組換えマウスのバックグランドマウスとして汎用されるC57BL/6Jマウス(日本SLC)を8週齢から使用した。飼育環境は、温度23 ± 1℃、湿度50 ± 10%、照明時間は12時間とした。飼料は日本クレア製のCE-2を、給水は市水を給水瓶により与えた。床敷はアルファドライ(エルエスジー?梶jを使用した。暗夜飼育の方法として、通常飼育(通常飼育群)と同じクリーンラックの一角に黒のビニールを貼り、暗夜飼育ゾーンとした(暗夜飼育群)。雄マウスは1匹飼いとし、雌マウスを雄に1:1で同居させ交配した。同居後、毎日膣栓を観察し、交尾後17日目に妊娠が確認されたマウスを、床敷を増量した個別のケージに入れ出産態勢とした。妊娠マウスは、妊娠した順に通常飼育群・暗夜飼育群それぞれ交互に振分け、各群10匹として比較した。産仔数は出産後3日目に数えた。離乳は出産後23日目に行い、仔獣の離乳時体重を測定した。マウスの観察は1日1回とした。
【結果】通常飼育群では10例中2例で、暗夜飼育群では10例中1例で食殺による保育放棄が見られた。平均産仔数は、通常飼育群で6.2 ± 2.8匹、暗夜飼育群で6.5 ± 2.6匹と、ほぼ同値であった。平均離乳数は、通常飼育群で5.1 ± 3.3匹、暗夜飼育群で6.3 ± 2.5匹と、統計的有意差はないものの暗夜飼育群で良好な結果が得られた。離乳時体重は、通常飼育群で9.9 ± 2.4 g、暗夜飼育群で9.7 ± 2.1 gと差は見られなかった。
【考察】今回、実験的に繁殖能力に問題のない健常系のB6マウスを用いて、簡易な暗夜飼育における繁殖成績について検討した結果、離乳数において良好な結果が得られた。以上の結果から、繁殖能力が低下しているマウスや食殺などの保育放棄をしやすいマウスの系統維持に、その効果が期待されると考えられた。 一般講演 12
○高橋 智輝1)、牛崎 克哉1)、佐藤 綾子1)、高橋 恵理1)、川村 祐介2)、遠山 稿二郎1)
(岩手医科大・動物実験センター1)、岩手大学2))
本学では平成18年度より医学部5学年を対象とした、ブタを用いた基本外科手技習得実習(開腹、腹腔鏡下、開胸、胸腔鏡下)を行っており、当センターが全身麻酔の導入から維持・管理を教育支援業務として行っている。
今回、実際の医療の現場で用いられているクリニカルパスを参考に、独自の基本外科手技習得実習におけるクリニカルパスを作成したので報告する。
【作成過程】
【考察】
従来使用していた飼育記録及びチェックシートは9枚にも及んでいた。今回パスを作成することで一枚の紙にすべての記録をすることができるようになり、一連の流れを把握することが容易となった。また、スタッフの観察の視点が同じになり、統一された処置を行うことができるようになったと考える。
【まとめ】
パスによりスタッフの業務の効率化を図ることができ、時間の余裕とともに心の余裕を持つことができるようになった。今後は発生したバリアンスの分析をしながら、さらに使いやすいパスを目指していきたい。
一般講演 13
東北大における改良型ウサギケージの紹介
○白幡 春菜、柏山 浩、末田 輝子、笠井 憲雪
(東北大学大学院医学系研究科附属動物実験施設)
当施設では、これまでに、奥羽・東北支部合同勉強会で2003年にサルの福祉、2006年にはブタとイヌの福祉を取り上げ報告してきた。今回はウサギ飼育ケージの改良と動物福祉につながったことを報告する。
実験動物は、その一生をケージの中で過ごす。そのことを考えると、作業効率や収容率といった人間側の都合のみでケージサイズを決定することには福祉上問題があるように思う。また、小さすぎるケージサイズが、ウサギ本来の習性を無視しているとするならば、実験成績に影響を与えないとは言えないと思う。
従来、我が国のウサギのケージサイズが欧米のそれに比べて明らかに小さいことが指摘されており、当施設でも例外ではなかった。1996年に米国National Research Councilから出版された「動物実験指針・第7版」によると、体重4 kgまでのウサギに推奨される飼育スペースは床面積0.28 m2である。これまで当施設で使用していたウサギ飼育ケージの床面積は0.18 m2だった。ウサギは飛び跳ねることもできず「窮屈」そうにジッとしていた。そこで当施設では、昨今ウサギの使用匹数が減少してきていることや、ケージ更新の時期にきていることなどの状況から、ウサギのケージサイズを大きくすることに決めた。
予算の関係上、既製のものをそのまま導入するのではなく、架台はそのまま転用し、それまでの2つ分のケージスペースを使って床面積0.30 m2のケージに改良した。今回の発表では、当施設のウサギケージの紹介とケージサイズを大きくしたことのメリットとデメリットを考察する。
また研究者にウサギの扱い方を教えるのも飼育管理者として重要である。ウサギは爪が鋭いため、怖々とウサギをつかむ研究者も少なくない。研究者がウサギを恐れるあまり手荒く扱ってしまい、ウサギが攻撃的になってしまったことも我々は経験している。ウサギの飼育環境を豊かなものにするべく我々が日常取り組んでいることを報告する。
一般講演 14
東北大学における学内規程運用の紹介と新規定における技官の役割
○末田 輝子、笠井 憲雪
(東北大学大学院医学系研究科附属動物実験施設)
2005年、我が国の「動物の愛護及び管理に関する法律」が改正され、翌年6月1日から施行されました。この改正動愛法には、実験動物福祉の基本理念である3Rが明確に記載されています。この改正に伴い、本年4月28日に「実験動物の飼養及び保管並びに苦痛の軽減に関する基準(環境省告示)」が公布され、また、文部科学省は�「研究機関等における動物実験等の実施に関する基本指針�」を制定し、平成18年6月に通知しました。これにより、我が国に於いても法令と指針に基づいて行われる実験動物の福祉と動物実験の適正化の体制が整備されました。
それら法令及び指針を基に、東北大学は、本学の動物実験が適切に行われるように「動物実験規程」を2007年6月27日に策定し、今年10月1日から施行しています。この規程には、動物実験における学長の責務、学長の諮問機関である動物実験委員会の任務、実験動物及び施設等を管理する「管理者」の任務、実験動物の管理を担う「実験動物管理者」の役割が明記され、「動物実験の教育」の重要性が強調されています。
この新しい時代の到来を迎え、私達技官が果たせる役割は非常に大きいと思います。私は、管理者(医学系研究科長)より、「実験動物管理者」に任命されました。今後の私の任務としては、これまでの現場での経験を活かし、実験動物飼養施設や実験室の設置や運営に関する助言、動愛法や規程の順守、実験動物福祉の実践、飼育管理や動物取り扱いの指導、倫理に基づいた動物実験の指導助言等があります。これらの業務を通して、研究者自身が実験動物福祉や動物実験の倫理について考える機会を増やしていきたいと考えます。
今回の発表では、本学での基準と運用の紹介、技官の役割について日常考えていることをお話ししたいと思います。